论文总字数:24057字
摘 要
多发性骨髓瘤(Multiple myeloma, MM)是一种起源于B淋巴细胞的血液系统疾病,其发病率在血液系统恶性肿瘤中排名第二。近年来,随着对MM病理生理学研究的不断深入,以及各种治疗方案的更新迭代,MM的临床治疗进展取得了长足的突破,但仍不足以达到根治的效果。大量文献资料和肿瘤实验结果显示,MM细胞中microRNA(miRNA, 微小RNA)的表达广泛下调。针对此现象,我们因此提出了一种靶向调节miRNA网络的思路,通过上调作为肿瘤抑制基因的miRNAs,阻止其靶基因的转录翻译过程,为MM的治疗提供实验依据。
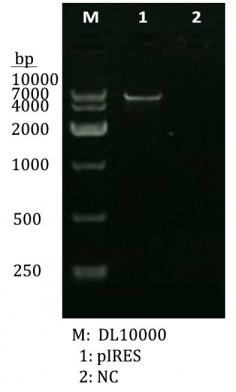
实验设计:我们探究了过表达miR-34a重组体在体外抗MM的能力。通过构建pIRES-miR-34a重组体,并将其转染至MM细胞系RPMI-8226中,对转染后的细胞进行悬浮培养、单克隆筛选,对筛选出的单克隆进行培养和各种体外鉴定,以探究miR-34a在MM细胞中的过表达对其增殖与凋亡的影响。最终的实验结果与所设想的相同。
结论:我们的研究证明,使MM细胞中miR-34a稳定表达能抑制MM细胞增殖、促进凋亡,在非临床试验中具有治疗活性,同时也提供了靶向miRNA-34a的MM治疗实验依据。
关键词:多发性骨髓瘤 microRNA 转染 筛选
Study of upRegulating miR-34a on Proliferation and Apotosis
to Multiple Myeloma
ABSTRACT
Multiple myeloma (MM) is the second most common hematologic malignancy in Western countries. Despite advances in the understanding of MM pathobiology and development of novel therapeutic strategies, available treat- ments fail to cure the disease in most cases . In most cases, we found that the expression of miRNAs occur to decrease.as to this phenomenon, we put forward a kind of therapeutic schedule aiming at the regulatory network of miRNAs what is to enforce the expression of tumor suppressor miRNAs。For instance,miRNA-34a.
Experimental design: we investigated the treatment potential of overexpression miR-34a recombinant vector for tumor experiment in vitro.in vitro, we build the piRES-miR-34a recombinant vector and transfect it to the RPMI-8226 tumor cells. In the later, through suspension cultivation, monoclonal Screening,and all kinds of identification tests, we investigate the effect for the growth and multiplication of tumor with the overexpression of miRNA-34a in tumor cell. The final result is the same as what we imagine at the beginning.
Conclusion:Our findings provide a proof-of-principle that enforce the overexpress of the miR-34a has thera- peutic activity in preclinical models and support a framework for development of miR-34a–based treatment strategies in MM patients.
Keywords:Multiple myeloma pIRES-miRNA-34a RPMI-8226 tumor cell
目录
中文摘要……………………………………………………………………………………………….2
英文摘要……………………………………………………………………………………………….3
正文
绪论………………………………………………………………………………………………………5
文献综述 ……………………………………………………………………………………………...8
课题实验-上调miR-34a对多发性骨髓瘤增殖与凋亡作用的研究
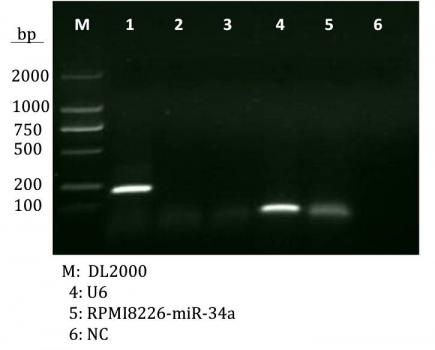
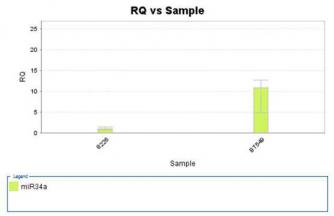
第一章miR-34a在多发性骨髓瘤细胞系中表达量的检测和鉴定
材料与方法……………………………………………………………………………………….15
结果…………………………………………………………………………………………………
讨论(一)………………………………………………………………………………………
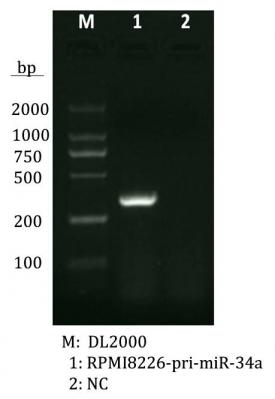
第二章 pIRES-miR-34a重组体的构建与鉴定………………………………………21
材料与方法………………………………………………………………………………………
结果…………………………………………………………………………………………………
讨论(二)………………………………………………………………………………………
第三章 RPMI-8226-pIRES-miR-34a稳转株的筛选及增殖与凋亡实验…34
材料与方法………………………………………………………………………………………
结果…………………………………………………………………………………………………
讨论(三)………………………………………………………………………………………
总结……………………………………………………………………………………………………39
致谢……………………………………………………………………………………………………40
绪论
一.研究背景
多发性骨髓瘤(Multiple myeloma, MM)是一种发病率很高的血液系统恶性肿瘤,起源于骨髓中的B淋巴细胞。目前WHO将其归为B淋巴细胞瘤的一种,称为B淋巴细胞骨髓瘤。MM在西方的发病率很高,死亡率也比较高,因此对其研究相对较全面,但是成熟有效的治疗方案至今仍然没有发现。近年来,关于多发性骨髓瘤治疗的研究热点逐渐转移到分子层面上,尤其是以siRNA和microRNA为代表的RNAi方法为MM的治疗带来了新的曙光。我们通过查阅文献和预实验发现,隶属于micro34家族的miR-34a与MM细胞的增殖凋亡等过程息息相关。在本实验中,我们检测了miR-34a在MM细胞系中的表达,并由此构建相应的重组体使miR-34a在MM细胞中稳定表达,借此探究miR-34a在MM发生发展过程中所发挥的作用。
二、选题的可行性和研究意义
2.1.可行性
有关microRNA与MM之间的关系在国内外文献中已有相关报道;我们通过文献检索对miR-34a的功能、下游靶基因以及其在MM发生发展中所发挥的作用有了初步的理解,因此本次实验可以基于这些理论为基础来进行大胆假设、小心求证,一步步探索深层的分子机制,为靶向microRNA的MM治疗方法提供实验依据。
2.2.研究意义
2.1 实验结果证明了miR-34a在MM中所起到的抑制作用
2.2 进一步为靶向microRNA的MM治疗方案的实验依据
三、技术路线
3.1 多发性骨髓瘤细胞系的选择以及其中miR-34a表达量的检测与鉴定

3.2 pIRES-miR-34a重组体的构建


3.3 RPMI8226稳转株的筛选及体外验证实验

文献综述
摘要:多发性骨髓瘤 (Multiple myeloma, MM)是西方国家发病率和死亡率较高的一种血液系统恶性肿瘤,对于其治疗的研究一直都是热点。近年来,研究人员的目光开始转向分子水平尤其是基因层面上。MicroRNA (miRNA, 微小RNA)是一种进化中非常保守的非编码蛋白质的微小RNA,广泛参与细胞的增殖、凋亡等许多复杂生命过程,人类基因组约有三分之一的基因接受miRNA的调控。miR-34a为近年来肿瘤研究中备受关注的微小RNA。目前研究发现 ,细胞中的miR-34a受到p53、染色体及p53启动子甲基化等因素的共同调节,并通过调节多种靶物质参与细胞的增殖与凋亡的调节。现就近年来 miR-34a 及其与肿瘤关系的研究进展进行综述。
关键词:miRNAs miR-34a 多发性骨髓瘤 p53 表观遗传学
Abstract: Multiple myeloma (MM) is the second most common hematologic malignancy in Western countries. Therefore, looking for the treatment method for Multiple myeloma is the hotspot all the time. In recent years, MicroRNA( miRNA) is a highly conserved short RNA in evolution, which does not encode proteins in cells. It extensively regulates the complex vital process, such as growth and development of cells. MiR-34a is one of the most concerned miRNAs discovered in recent years. Current studies found it was regulated by chromosome,p53 and promoter methylation in cells, and it might regulate the proliferation and apoptosis of cells by multiple target molecules. Here is to make a review on miR-34a and its relationship with tumors.
Keyword:miRNAs miR-34a Multiple myeloma(MM)
- 多发性骨髓瘤
1.1 多发性骨髓瘤的发病背景
对于多发性骨髓瘤细胞的认识已经经过了几百年的发展。在1873年被正式命名为多发性骨髓瘤(MM),多发性骨髓瘤是一种恶性淋巴细胞疾病,其肿瘤细胞起源于骨髓中的淋巴B细胞,现在WHO将其归为B细胞淋巴瘤的一种[1],称为淋巴细胞骨髓瘤。多发性骨髓瘤早期主要侵犯全身骨细胞,导致骨折,溶骨性骨重吸收等一系列临床症状,同时患者会出现免疫球蛋白异常,导致免疫力紊乱或下降,引发细菌感染,到中后期往往还会出现肾损害的并发症,并因此造成高死亡率。在西方国家,多发性骨髓瘤的发病率相对较高,而其在我国的发病率估计为2~3/10万,排名血液系统恶性肿瘤的第二位,其中男人和女人的比例大约为1.7:1.0,其中绝大部分病人年龄大于38岁。MM病程缓慢,早期不会出现明显症状,因此很容易诊断错误,它的临床表现很多,主要有贫血、骨痛、肾功能不全、感染、出血、神经症状、高钙血症、淀粉样变等。
。
1.2 MM的诊断与治疗
1.2.1 MM的诊断标准
(1)骨髓内异常浆细胞数≥10%或骨髓的活体检测为浆细胞瘤;(2)血液或尿中检测到MM蛋白;(3)产生MM系列并发症,如血液Ca2 变多、肾功能不全、贫血、溶骨性病变等[2]。只要满足以上3个条件就可以鉴定为MM阳性。
1.2.2 MM的治疗
最初MM的治疗主要是传统且常规的放化疗以及维持治疗,目的在于尽量延长患者的生存时间和生存质量,而近几年对MM的研究的不断加深,开始涌现出各种各样的新型治疗方案,比如自体或异体造血干细胞移植和基因治疗手段。
(1)MM的干细胞移植治疗
自体干细胞(Autologous stem cell transplantation, ASCT)尽管不能彻底治愈MM,但是能够有效的改善患者的生存周期和生存质量。
优点:能够显著的降低MM患者的死亡率至2%-3%,ASCT可以与很多MM治疗药物联用,可以有效提高预后,对于难治性耐化疗MM患者具有不错的效果。
缺点:ASCT由于需要大剂量的马法兰进行预处理,因此65周岁以上或肾功能不全的患者需谨慎使用。ASCT对于那些经过诱导化疗治疗后的患者来说[3],并不能明显提高其生存率;而且大部分此类患者在接受ASCT治疗后,MM复发时间缩短。
(2)异基因干细胞移植(Allogeneic hematopoietic stem cell transplantation, Allo-SCT)
Allo-SCT是基于ASCT治疗的一种全新改良方法。
优点:移植载体相对于ASCT来说更安全,不受骨髓瘤细胞污染,而且该载体还具有抗MM的作用。
缺点:相对于它的优点,缺点十分明显。年龄的限制,器官的功能损伤以及移植所导致的高死亡率等因素导致了Allo-SCT治疗方案的使用局限性与普及性。
(3)靶向治疗新药
Bortezomib(硼替佐米, PA341)
该药物为蛋白酶体抑制剂,能够用于治疗晚期MM。
优点:单独用药用于早期患者,缓解率可达到40%;与其他的药剂联合使用,则缓解率可增至70%。对于易复发难治的MM,通过实验结果表明,缓解率依然可以达到近45%。
缺点:少数患者可能会出现DVT[4](Deep vein thrombosis, 深静脉血栓)以及不可逆神经症状。由于可联用的药物众多,尚未确定哪一种药物是最好的联用药物,因此与多种药物联合使用可能会产生一些毒副作用。
Lenalidomide(雷利度胺, CC-5013)
该药物属于反应停类药物,是一种新开发出来的用于治疗MM的药物,并且通过多次临床试验,可以说是一种很有前途的药物。
优点:这种药物相较于反应停来说,便秘、神经损伤等副作用较少发生,如果用于联合治疗复发难治性MM,则其疗效明显优于单独使用的地塞米松。
缺点:具有一定的血液系统和非血液系统毒性。血液系统毒性主要体现为中性粒细胞和血小板的减少。
二、microRNA和miR-34a
目前,虽然有药物和干细胞移植方法用于治疗MM,但是都不可避免的产生两个问题:1.无法彻底治愈; 2.治疗副作用。因此科学家们开始重新思考治疗方案。随着肿瘤基因治疗的进步,研究人员渐渐把研究方向转移到分子水平上。近年来,越来越多的临床实验研究发现,在MM的整个发生发展过程中,microRNA发挥了至关作用的作用。
2.1 microRNA
真核生物中广泛存在大量不编码蛋白质的转录产物RNA,其中MicroRNA(miRNA,微小RNA)是在真核生物中发现的一类具有调控功能的内源性的不编码单链RNA,长度约20-27个核苷酸[5]。成熟的微小RNA是由较长的转录产物经过一系列核酸酶(Drosha、Dicer酶等)的剪接处理而产生的,接着组装进RNA诱导的沉默复合体(RNA-induced silencing complex, RISC),通过碱基互补配对的方式识别靶mRNA,并根据互补情况的差异指导沉默复合体降解靶mRNA或阻遏靶mRNA的翻译。最近的研究表明微小RNA参与多种调节途径,包括发育、病毒感染、造血机制、器官发育、细胞生长和凋亡、脂肪代谢等等[6]。至今为止,在生物体中已经发现有高达4000多个miRNA分子,大部分的miRNA以单拷贝、多拷贝或基因簇的形式存在于基因组中[7]。miRNA在细胞内发挥各种各样重要的调节作用,每个微小RNA可以有多个靶基因,而多个miRNA也可以共同调节同一个靶基因, 这种复杂的调节机制既可以通过一个miRNA来调节多个基因的表达,也可以通过几个miRNA的组合来精细调节某个基因的表达得以实现。据推测,人类基因组约三分之一的基因接受miRNA的调控[8]。大量研究表明,miRNA与肿瘤的发生、发展、治疗 和预后之间存在密切的联系。因此,对于miRNA的深入研究,对进一步揭示肿瘤发病机制、早期诊断和新治疗方案的探索有着重大的意义。
2.2 miRNA功能的研究方法
2.2.1上调或下调miRNA的表达
控制miRNA的表达,如上调或下调能有效的判定该种miRNA在肿瘤发展过程中起到的积极或消极作用,敲除选定的miRNA或进行过表达重组体的转染可用于研究miRNA 在肿瘤生长和增殖过程中的作用[9]。 本课题中所选用的方法就是使miRNA过表达。
2.2.2 northern blot杂交技术
Northern blot杂交是建立在RNA水平上的一种基因探测技术。其在基因的探测分析领域应用很广泛,是一种可靠的探测技术。目前,该技术也被用于探测肿瘤细胞中 miRNA的表达[10]。例如,通过正常骨髓细胞与MM细胞,或者两种不同MM细胞中miRNA表达的比较分析,可以检测并鉴定miR-34a在MM细胞中的表达情况[11]。
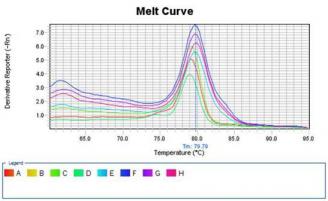
2.2.3 Real-time PCR
剩余内容已隐藏,请支付后下载全文,论文总字数:24057字
相关图片展示:
该课题毕业论文、开题报告、外文翻译、程序设计、图纸设计等资料可联系客服协助查找;