大肠杆菌利用甲醇代谢的路径组装及调控研究毕业论文
2020-05-25 23:42:42
摘 要
甲醇来源丰富,价格低廉,并且含能高,能为目标产物的合成提供充足的还原力。大肠杆菌是最常用的细菌,易于成活,目前对它的研究比较透彻。随着合成生物学的快速发展,在模式菌株中构建甲醇代谢途径成为可能,而为解除菌株对氧的依赖,依赖NAD的甲醇脱氢酶被认为是在模式菌株中组装甲醇代谢途径的最优选择,同时基于对核酮糖单磷酸途径(RuMP),核酮糖二磷酸途径(RuBP)以及丝氨酸循环途径生产丙酮酸过程中生物量,辅因子ATP以及NAD(P)H的产生能力的化学计量计算,其中RuMP途径被认为是在模式菌株中组装甲醇代谢途径的最优选择。基于实验室现有的分子生物学技术与方法,我们成功构建了几株可以利用甲醇进行代谢的大肠杆菌,它们通过RuMP途径生成6-磷酸果糖,使得这些一碳生物质能够流向中心碳的方向进行代谢,并在其体内测出了甲醇脱氢酶的酶活。这证明本实验室采取的方法是正确的,菌株能够利用甲醇进行代谢。
关键词:甲醇代谢 大肠杆菌 分子生物学 酶活
Study on assembly and regulation of methanol metabolism in Escherichia coli
Abstract
Methanol rich source, low prices and high energetic, able to target product synthesis provide sufficient reducing power. E. coli is the most common bacterial, easy to survive, it is currently more thorough study. With the rapid development of synthetic biology becomes possible to build a methanol metabolic pathway in strain mode, and for the lifting of the strain dependence of oxygen, NAD-dependent methanol dehydrogenase is considered to be assembled in a methanol metabolic pathway model strain Optimal select, based on both of ribulose monophosphate pathway (RUMP), ribulose bisphosphate pathway (of RuBP) pathway and serine production cycle during chemical biomass pyruvate, ATP, and cofactors ability to produce NAD (P) H in metering calculations, which RuMP pathway is believed to be assembled in a methanol metabolic pathway model strain optimal choice. Existing laboratory-based molecular biology techniques and methods we can use successfully constructed several strains of E. coli metabolism of methanol, which is generated by fructose-6-phosphate RuMP way, so that these directions biomass can flow to the central carbon-carbon metabolized, and its volume measured in a methanol dehydrogenase activity. This proves that the methods of the laboratory take is correct, the strain can utilize methanol metabolism.
Key Words: Methanol metabolism; Escherichia coli; Molecular biology;Activity
目 录
摘 要 I
Abstract II
第一章 文献综述 2
1.1研究意义 2
1.2甲醇微生物研究现状 2
1.3合成甲醇代谢模式菌株的研究现状 2
1.4 合成生物技术研究现状 2
第二章 实验方法 2
2.1菌株与质粒 2
2.2 实验材料 2
2.2.1实验试剂 2
2.2.2 实验仪器 2
2.3 培养基与试剂配制 2
2.3.1培养基的配制 2
2.3.2电泳相关溶液的配制 2
2.4大肠杆菌感受态细胞的制备 2
2.5 基因合成 2
2.6质粒提取 2
2.7酶切与连接 2
2.8质粒进行胶回收与片段DNA纯化 2
2.8.1把验证后的片段进行胶回收 2
2.8.2将酶切之后的片段进行DNA纯化 2
2.9转化 2
2.10菌落PCR 2
2.11基因敲除 2
2.12 发酵 2
2.13 总实验流程 2
第三章 结果与讨论 2
3.1质粒与菌株构建 2
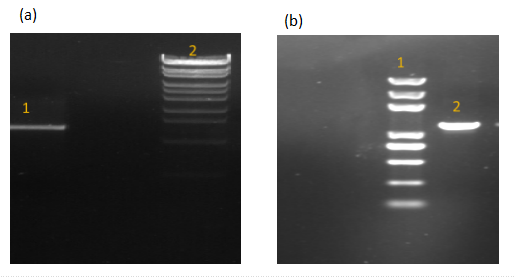
3.1.1片段验证 2
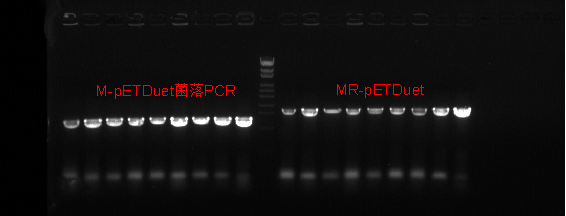
3.1.2菌株验证 2
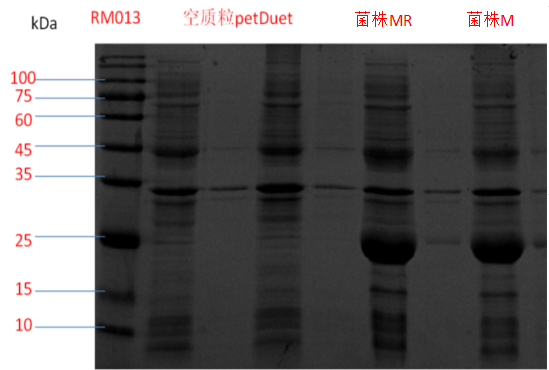
3.2重组蛋白SDS-PAGE凝胶电泳 2
3.3 甲醇和甲醛检测方法的建立 2
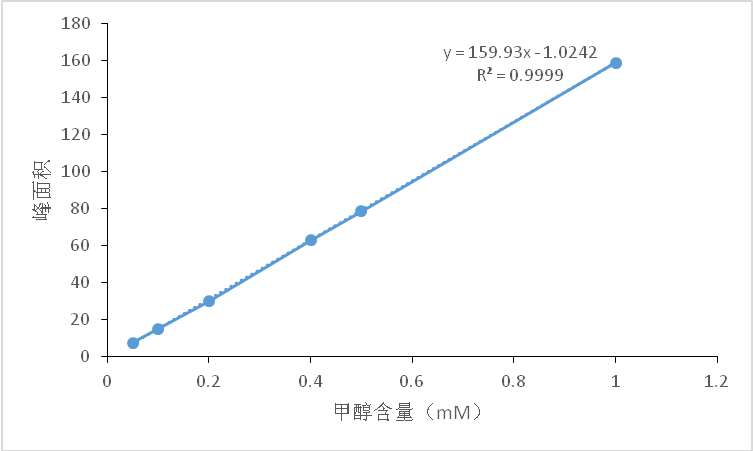
3.3.1气相色谱检测甲醇 2
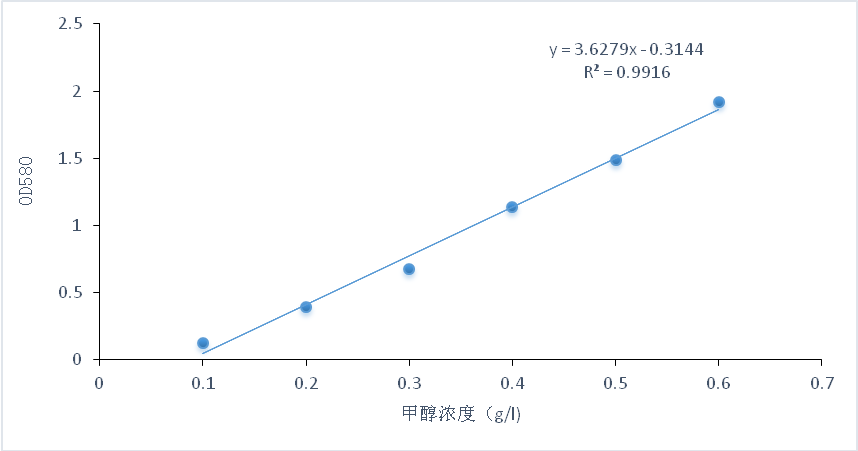
3.3.2 氧化品红亚硫酸比色法测定甲醇含量 2
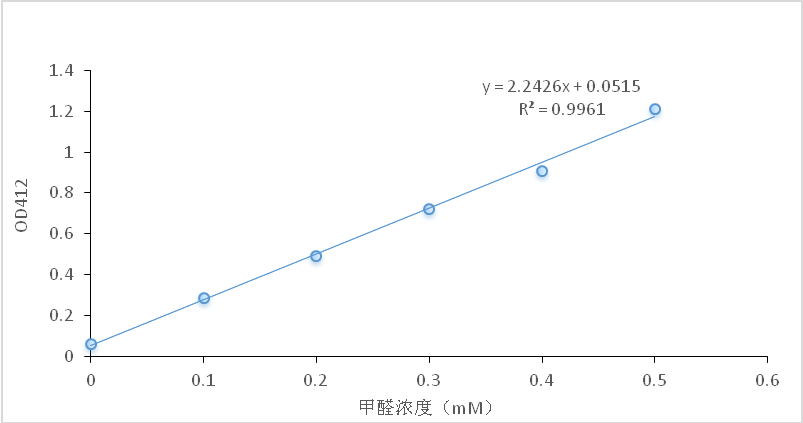
3.3.3Nash反应检测甲醛 2
3.5 菌株发酵 2
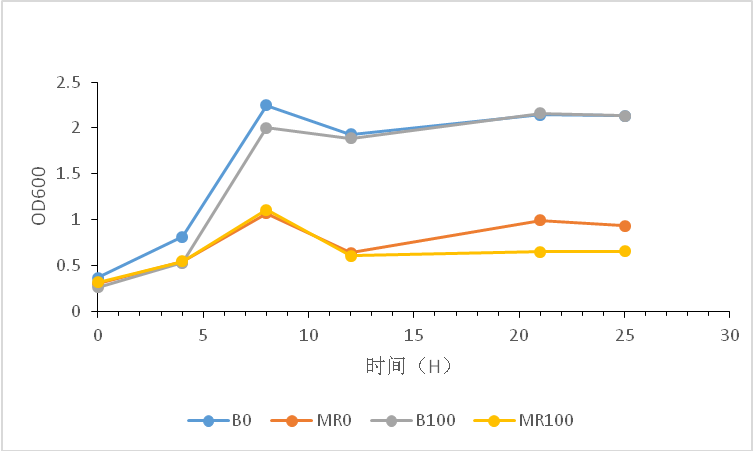
3.5.1不同浓度的甲醇发酵 2
3.5.2不同糖浓度下的发酵 2
3.7frmA基因的敲除对甲醇代谢的影响 2
3.8 单敲菌对酶活的影响 2
第四章 结论与展望 2
4.1 结论 2
4.2 展望 2
参考文献 2
致 谢 2
第一章 文献综述
1.1研究意义
随着基因工程、代谢工程的发展和合成生物学的崛起,人类改造微生物作为细胞工厂用于生产各种产品的能力得到了极大的提高,可以改进、重组甚至完全创造微生物合成途径以满足社会发展需要,微生物发酵产品涉及到人类当前发展中所面临的能源、材料、 环境、医药、食品等关键领域,如燃料乙醇、各类抗生素、食品添加剂等[1]。当前生物制造的原料仍以粮食为主,据统计2014年全球约12%的谷物粮食被用于生物制造产业[2],在中国这一比例高达20%[3]。随着粮食危机日益加剧以及粮食价格不断攀升,以粮食为原料的生物制造正面临严峻考验。因此,解决原料来源问题对于提高中国生物制造的竞争力,实现生物制造的可持续发展至关重要。2013年, George A. Olah提出“甲醇经济发展模式”——以甲醇为原料制造生活所需品,缓解人类对化石资源的依赖[4]。与其他原料相比,甲醇具有以下优势:1. 原料来源丰富,天然气、工业废气中的CO2、煤炭、可再生生物质等均可高效合成甲醇[5];2. 价格低廉,目前甲醇价格约为市售葡萄糖价格的1/3;3. 含能高,为目标产物的合成提供充足的还原力。因此,若以甲醇取代目前粮食作为原料用于生物制造,将可以大幅降低生产成本,提高生物基产品的竞争力,实现生物制造的可持续发展。
1.2甲醇微生物研究现状
自然界中存在能够天然代谢甲醇的微生物,如真核类巴斯德毕赤酵母、汉逊酵母和假丝酵母等以及原核类甲醇芽孢杆菌(Bacillus methanolicus)、甲基单胞菌(Methylomonas methanolica)和甲基杆菌(Methylobacterium Extorquens)等[6-8]。从天然甲醇微生物出发,以甲醇为原料发酵合成了氨基酸(丝氨酸、谷氨酸和赖氨酸)、生物聚合物以及单细胞蛋白等[6-10]。近年来随着代谢工程技术的发展,天然甲醇微生物的遗传操作工具有一些报道,以菌株Methylobacterium extorquens AM1为宿主细胞,通过代谢工程改造,以甲醇为原料发酵合成了正丁醇、甲羟戊酸以及戊二胺等化学产品 [6-10]。然而,天然甲醇营养菌仍难以被改造为高效的细胞工厂,一方面,大多数甲醇营养菌是严格好氧型,代谢物的生产效率较低[11],另一方面,菌株遗传操作工具低效落后,限制了菌株的代谢工程改造以及在化学品生产方
面的潜力[11, 12]。随着合成生物学的快速发展,在模式菌株中构建甲醇代谢途径被认为是实现甲醇高效生物转化的有效途径[12]。
1.3合成甲醇代谢模式菌株的研究现状
在甲醇营养菌株中,甲醇经甲醇脱氢酶氧化生成甲醛,进而通过原核生物的磷酸核酮糖途径(简称RuMP途径)或丝氨酸循环途径,以及真核生物的二磷酸核酮糖途径(简称RuBP途径)流向中心碳代谢[12]如图1所示。其中甲醇脱氢酶中包括三类:1.依赖PQQ的甲醇脱氢酶,2.依赖NAD的甲醇脱氢酶(Mdh),3.依赖氧的甲醇脱氢酶[12]。为解除菌株对氧的依赖,依赖NAD的甲醇脱氢酶被认为是在模式菌株中组装甲醇代谢途径的最优选择[12]。同时基于对RuMP途经,RuBP途径以及丝氨酸循环途径生产丙酮酸过程中生物量,辅因子ATP以及NAD(P)H的产生能力的化学计量计算,其中RuMP途径被认为是在模式菌株中组装甲醇代谢途径的最优选择[12]。基于以上设计策略,国外研究者已开展重组模式菌株代谢甲醇的初步研究:(1) Muller(2015)等人首次在大肠杆菌中成功组建甲醇代谢途径,并通过C13标记实验证实了引入的异源模块在大肠杆菌中与内源路径形成完整的循环通路[13]。(2) Witthoff(2015)等人将类似的代谢模块引入谷氨酸棒状杆菌中,重组谷氨酸棒状杆菌在以葡萄糖和甲醇为混合碳源时甲醇的平均消耗速率达1.7 mM/h [14]; (3) Leßmeier(2015)等人构建得到含有甲醇代谢模块和赖氨酸脱羧酶的重组谷氨酸棒状杆菌,以葡萄糖和C13标记甲醇为共同碳源进行发酵时,检测到C13标记的戊二胺 [15]。目前国内在非甲醇营养的模式微生物(如谷氨酸棒杆菌、大肠杆菌等)中组装甲醇代谢途径的研究还未见报道。

图1 甲醇代谢[14]
1.4 合成生物技术研究现状
合成生物学是基于生物、化学、物理、计算机等多学科交叉和融合,采用工程化设计理念,对生物体进行有目标的设计、改造、乃至重新合成,甚至创建具有非自然功能的“人造生命”。合成生物学打破了生命与非生命的限制,打开了从非生命化学物质向生命物质转化的大门。美国国防部在2014年5月的《国防部科技重点》的报告中将合成生物学列为六大颠覆性基础研究领域之一。英国商业创新部将合成生物学列为未来最重要的八大技术之一。麦肯锡全球研究所将合成生物学评价为未来的颠覆性技术。近年来,采用合成生物学方法,通过模块的重构和优化,成功实现了以木糖或CO2为原料的生物转化[16, 17],为发展和利用新的碳资源提供了可能。通过在大肠杆菌中导入异源代谢模块,重构代谢途径,上下游模块适配调控以及代谢通量优化等手段,成功获得一系列高效的人工合成细胞工厂[18, 19]。这些研究为改造大肠杆菌获得甲醇代谢的能力奠定了系统的理论基础以及技术指导。本课题的完成将为解决生物制造产业的原料问题提供了可能,为提高生物制造竞争力提供新的研究思路。
相关图片展示:
课题毕业论文、开题报告、任务书、外文翻译、程序设计、图纸设计等资料可联系客服协助查找。



