MOF-73(Mn)纳米载药系统的制备毕业论文
2020-04-08 12:38:45
摘 要
阿霉素(Doxorubicin,DOX)是一种广谱抗癌药物,普遍应用于肝癌、乳腺癌、胃癌、等肿瘤的治疗。但其毒副作用较大、水溶性差等缺陷严重限制了其临床应用的有效性。本课题采用含锰的新型MOF材料(以2-叠氮基-1,4-对苯二甲酸(BDC-N3)作为桥接连接体)作为模板材料进行结构修饰,合成一种新的MOF材料作为纳米载药系统。选取MOF材料作为载药系统,除载药量高外,还具有种类多样性、结构可设计性与可调控性等优点,目的是为了提高药物治疗的有效性、靶向性,减少了药物的毒副作用,使阿霉素在肿瘤的临床治疗上取得更高的利用率。本课题主要研究了新型MOF材料纳米载药系统的制备与表征,该系统的合成分为三步:
(1)合成2-叠氮基对苯二甲酸
(2)合成BDC-Mn (新型MOF材料)
(3)合成MOF(Mn)-triazole-PEG-Mal/COH3
关键词:纳米载药系统;阿霉素;新型MOF材料;结构修饰
Abstract
Doxorubicin (DOX) is a broad-spectrum anticancer drug commonly used in the treatment of liver cancer, breast cancer, gastric cancer and other tumors. However, its toxicity and side effects, poor water solubility and other defects seriously limit the effectiveness of its clinical application. This topic uses a new type of MOF material containing manganese (2-azido-1,4-terephthalic acid (BDC-N3) as a bridging linker) as a template material for structural modification to synthesize a new MOF material as Nano Drug Delivery System. MOF materials as a delivery system in addition to the high drug loadings, also with species diversity, structure design and regulation of advantages, such as, the purpose is to improve the effectiveness of drug therapy, targeted, reduce the side effects of drugs, making the clinical treatment of doxorubicin in tumor of better utilization. This paper mainly studies the preparation and characterization of a new MOF nano-drug loading system. The synthesis of this system is divided into four steps:
(1) synthesis of 2-azo - terephthalic acid
(2) synthesis of BDC-Mn (new MOF material)
(3) synthesis of mal-peg (click)/bdc-Mn
Key words: Nano-drug loading system; Adriamycin; New MOF materials; Structural modifications
目录
第一章 绪论 7
1.1前言 7
1.2 纳米载药系统 7
1.2.1纳米载药系统的特点 8
1.3 载体材料的选取 11
1.4本课题研究内容 13
第二章 新型MOF(Mn)纳米载药系统的制备 15
2.1引言 15
2.2主要实验试剂与仪器 15
2.3实验部分 17
2.3.1 2-叠氮基对苯二甲酸的合成 17
2.3.2 合成BDC-Mn (新型MOF材料) 17
2.3.3合成Mal-PEG(click)-MOF 18
2.3.4合成PEG(click)-MOF/DOX 18
2.4 表征部分 18
2.4.1 1H-NMR表征 18
2.4.2 红外光谱表征 18
2.4.3 新型MOF材料载药量的测定 19
2.4.4 纳米粒粒径、粒径分布以及表面电势 19
2.4.5 纳米粒稳定性能研究 20
2.5实验结果与讨论 20
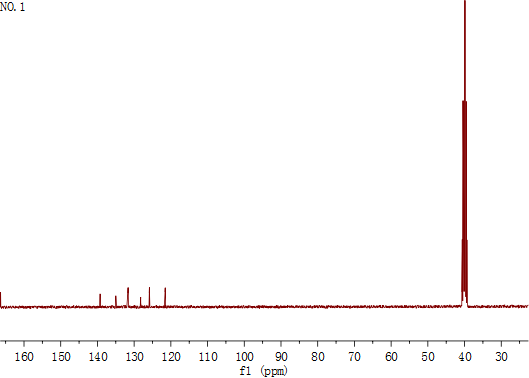
2.5.1红外图谱解析 20
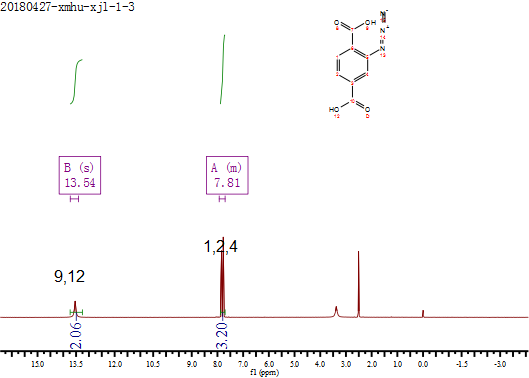
2.5.2核磁共振氢谱图解析 21
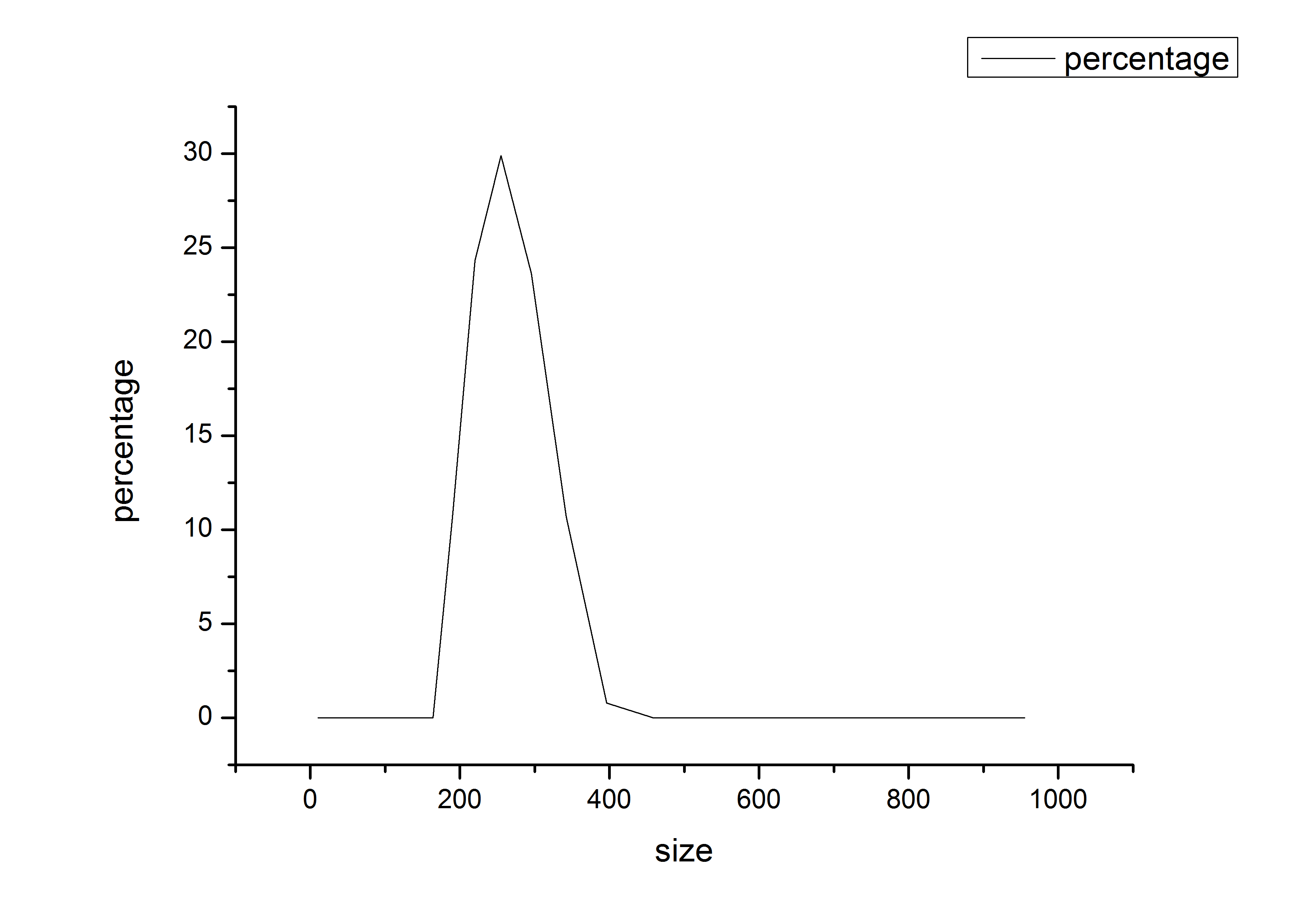
2.5.3纳米粒形态分析及形貌观测图谱解析 23
2.6本章小结 26
第三章 结论与展望 28
参考文献 30
致谢 34
第一章 绪论
1.1前言
查询世界癌症报告的数据得知,我国癌症患者逐年增加,死于癌症的人数也是十分庞大,预计到2020年,我国每年新发的癌症病例和死亡人数将分别高达388万和276万【1】。
目前,在全球范围内的癌症治疗的治疗方法主要有手术、化疗和放疗等方式。临床应用的抗肿瘤药物很多,化疗是目前临床治疗癌症的最主要的方法。然而,由于化疗药物发挥作用的方式是通过直接干扰细胞的代谢或增殖过程,因而缺乏选择性,导致化疗药物在杀死人体内癌细胞的同时,对人体正常细胞组织也会产生比较大的杀伤作用,因而药物治疗特异性差,对人体的正常组织和器官的毒副作用比较大。多数化疗药物会对人体内的正常组织产生刺激性,此外因化疗过程中癌细胞的生物化学过程改变等原因而产生耐药性甚至交叉耐药性。这些都是导致化疗失败的原因【2,3】。
受益于抗肿瘤药物发展的成果,已经设计了大量化疗方案,显示了抑制或减缓癌细胞生长的令人满意的效果。为了克服化疗药物毒副作用大的缺点,药物研究工作者们一方面积极开发更安全有效的新药,同时开发原有的化疗药物新剂型,试图通过新的药物传递系统提高已有化疗药物的疗效的同时降低其毒副作用,由此提出了靶向纳米给药系统的新概念,通过纳米给药系统的主动和被动靶向作用,使化疗药物在肿瘤组织浓集,在极大程度上增强化疗药物的疗效,同时减少了对正常组织和细胞的毒副作用,为癌症的药物治疗提供了一条十分辽阔的全新途径【4】。
一个理想的药物传递系统应具有以下功能:(1)可延长药物的人体内部的循环时间;(2)可提高化疗药物在人体内的水溶性;(3)可在肿瘤细胞内快速释放药物;(4)载药纳米粒可通过增加的渗透和保留作用在肿瘤部位浓集;(5)可减少化疗药物对正常细胞的毒性;(6)可在表面修饰可与癌细胞表面过度表达的抗原特异性结合的靶向分子,从而到达主动靶向的作用【5】。为实现以上功能,研究工作者们进行了大量有关纳米载药系统的研究。
1.2 纳米载药系统
纳米载药系统(Nano Drug Delivery System,NDDS),是指采用共价偶联的化学手段或者包埋、吸附等物理方法将小分子药物与天然、合成的载体分子整合在一起,制备成为纳米尺寸大小的药物传递系统,目前已经成为医学界研究的重点方向【6】。研究发现,将纳米技术应用于药物传输而构建的纳米载药系统,不仅可以特异性识别病变部位,还能够实现药物的控制性释放,因此极大程度上的提高了药物的生物利用度,并有效减少了系统毒性。
1.2.1纳米载药系统的特点
纳米无机/有机生物医用复合材料的创意来自于天然组织。人体的绝大多数组织都可以等同的视为复合材料,例如骨骼、牙齿等部件就是由纳米磷灰石晶体和高分子组成的纳米复合材料,它们都具有良好的力学性能,研究者们通过对天然硬组织的模仿,已经制备出一些纳米生物医用复合材料。
纳米载药系统与其他药物传递系统相比较,纳米载药系统具有特别的化学和物理性质,使其在药物传递方面有得天独厚的优势。
1.2.1.1 尺寸优势
纳米载药系统最为显著的优势在于它是一种具有纳米尺寸的小颗粒。通常认为,纳米载药系统的粒径在10-1000nm范围内。纳米载药系统合适尺寸的关键在于其形式上适合生物技术的需要,而并不受限于10-1000nm。纳米载药系统的尺寸可能与多肽、蛋白质或核酸等体内生物大分子相当,并且远远小于肿瘤细胞的大小【7】。由于其尺寸大小,纳米粒子比微米粒子能负载更多的药物分子进入细胞,并且细胞内吞效果存在显著的优势。此外,纳米药物在细胞外介质中能与生物分子互相作用,从而干扰肿瘤细胞的生存和增值。
1.2.1.2 靶向特性
纳米载药系统具有定位靶向特性,能够定向的将药物运输到病变细胞部位,同时可以减少正常组织及细胞对药物的摄取,降低系统毒性,并有效提高了药物在病人体内的生物利用度。其中纳米载药系统的靶向性包含主动靶向和被动靶向。
主动靶向是指采用物理、化学或生物方法将药物导入到病变部位,针对病变细胞进行定向治疗。与正常的细胞相比较,肿瘤细胞表面上一般会特异性地高表达某些DNA,所以能够采用能与肿瘤细胞表面分子特异性结合的配体修饰纳米粒,使纳米粒能特异性识别肿瘤细胞,从而实现药物的主动靶向传输,达到提高抗肿瘤的效果。
被动靶向是指由于肿瘤组织、细胞的物理化学或者外在药物因素,使得载药系统具有在病变部位聚集的特点,主要包括肿瘤微环境(Tumor Microenvironment)靶向和EPR(Enhanced Permeability and Retention)靶向。
1.2.1.3 表面多功能性
纳米载药系统拥有较大的比表面积,通过对纳米颗粒表面上的部位进行修饰,可以有效的实现纳米颗粒的多功能性,从而大大提高肿瘤治疗的效率。
1.2.1.4 改善传统化疗药物缺陷
传统化疗药物存在很多缺陷,通过对纳米载药系统的研究可以有效的改进传统化疗药物的这些缺陷:
- 增加药物溶解度。纳米药物传递系统(例如脂质体,聚合物胶束,无机高分子等)通过化学键合或物理嵌入在纳米颗粒核心装入疏水性化疗药物分子,这可有效增加药物的溶解度并促进肿瘤细胞对药物分子的摄取。
- 提高药物稳定性。纳米药物输送系统将化疗药物包裹在疏水核心中,为药物提供稳定而隐藏的储存空间,有效的避免了血液循环过程中的降解或者失活,从而保证了药物的生物活性。此外,纳米药物传递系统还可以完全改变药物的给药方式,使得活性药物可以口服,并且能够减少次数和剂量,从而有效的降低了“多重耐药性”发生的概率。
- 提高药物利用度。由于纳米粒子的表面积大,分散性高,有效地增加了药物与病变生物膜接触面积。同时,包含在纳米颗粒核心中的药物可以显著延长药物在血液循环系统中的时间,从而提高药物的利用度。
- 实现药物的控制释放。纳米载药系统能够通过调整载体药物的类别、配比等各种参数,来实现药物的控制释放。
- 可以消除特殊生物屏障对药物扩散进入循环的限制。机体拥有许多自我保护的天然生物屏障,如血眼屏障、血脑屏障、细胞生物膜屏障等,使得药物难以到达病变部位,给许多疾病的治疗带来了困难。纳米载药微粒可以轻易的穿过这些屏障部位,治疗疾病,从而减轻患者的痛苦。
- 纳米载体通过特殊加工增加特异性识别作用之后可以制备成靶向定位系统,更加精确地针对病变的组织或器官进行定向给药,可以减少药物不良反应。
1.2.2纳米载药系统的分类
目前,用于抗癌药物传输的纳米载药系统种类很多,依据载体材料的类型,可大概分为三类:基于聚合物类纳米颗粒(Polymer-based Nanoparticles)、基于脂质体类纳米颗粒(Lipid-based Nanoparticles)和无机纳米颗粒(Inorganic Nanoparticies)【8】。
- 基于聚合物类纳米颗粒
聚合物类纳米颗粒是以聚合物材料作为载体而构建的药物载药系统。由于大多数的聚合物材料具有良好的生物相容性和生物体内可降解性,因此特别符合适合作为药物传输载体的要求。根据聚合物载体材料的组成以及载体的结构可以分为聚合物胶束、聚合物纳米粒子和聚合物囊泡三种【9】。
多聚物-药物结合物是用某种化学反应将药物与多聚物载体交联,再将反应产物按一定方法制备成纳米大小的载药颗粒。将药物与多聚物交联往往用来增加药物在血液循环系统中的保留时间,将药物靶向到特点器官,或维持药物在注射部位的持续释放。将药物与聚合物交联还可能会增强药物的效用。
- 基于脂质体类纳米颗粒
脂质体类纳米颗粒通常是采用天然或人工合成的类脂为载体。由于类脂材料具有如同人类细胞膜磷脂双分子层的结构,具有良好的生物相容性,因而该系统可同时装载亲水性和疏水性的药物分子,亲水性药物装载在脂质体内,疏水性药物则可以装载在表面的磷脂双分子层之间。
- 无机纳米颗粒
无机纳米颗粒制备简单,具备良好尺寸及形状可控性,同时由于无机材料具有独特的光、电、磁等性质,使得无机纳米颗粒的应用非常广泛,不仅可用于药物传输,同时还可以用作肿瘤成像以及肿瘤靶向治疗等【10】。常见的无机纳米颗粒包括:磁性纳米颗粒、介孔二氧化硅纳米颗粒、碳纳米颗粒、金纳米颗粒等。
1.3 载体材料的选取
1.3.1纳米药物简介
纳米药物在实际上的内容就是纳米复合材料,是按照研究者的意志组装合成的纳米结构系统。纳米复合材料是由纳米颗粒以及它们组成的纳米丝、管和囊为基本单位在一维、二维和三维空间组装排列成具有纳米结构的体系。目前现代的药物研究就是利用高科技手段,使药物具有更多的优点。如好的稳定性、毒副作用小、药物利用率高、可靶向给药、有缓释作用等,而纳米药物恰恰可以改造具有这些优点。
1.3.2纳米载药材料应具备的特点
药物载体材料本身应该具有化学和生物学惰性,使其不会与抗肿瘤药物反应或对人体器官造成损害。每个有效的药物递送都应符合以下要求:(1)高药物负载能力;(2)生物相容性;(3)对病理生理环境的反应;(4)被动或主动靶向;(5)到达目标部位之前没有释放;(6)药物不应与生物液体分解;(7)药物递送-协同效应;(8)能够通过成像技术进行表面修饰检测。
有效载荷能力是成功DDS的关键因素,因此剂量应该被精确控制。太多或太少对治疗过程都是不利的。为了解决剂量不足造成的低效问题,药物储存量大的材料是首选。通过应答肿瘤环境中存在的刺激信号,药物载体平台释放药物以实现其药物传递目的。更重要的是,零释放直到刺激信号被应用是这些系统中不可或缺的特征。目前已经开发了许多基于纳米粒子的药物传递系统,用于生物医学应用。然而这些纳米材料中的每一种都有自己的局限性,例如有机平台倾向于表现出对药物释放的不足控制,而无机平台的低负载效率和生物相容性常常不能满足治疗的需求。
1.3.2 MOF材料的优点
纳米金属-有机骨架(Nanoscale metal-organic frameworks,nMOFs)是由过渡金属离子与有机配体通过自组装过程形成的周期性网络结构的晶体多孔材料。它主要包括两个重要的组分:结点和联结桥。金属有机骨架(MOF)是由与有机配体配位的金属离子或簇组成的化合物。通过金属阳离子和有机配体之间的配位相互作用,可以形成一维,二维或三维网状结构。它们是配位聚合物的一个亚类,其特征是它们通常是多孔的。金属和接头的选择决定了MOF的结构和性质。例如,金属的配体偏好通过规定多少配体可以结合到金属上并以哪个取向来影响孔的尺寸和形状。对于MOF,典型的桥连配体是二羧酸和三羧酸。这些配体通常具有刚性骨架。
MOFs具有许多优点:(1)MOFs制备简单。羧酸以及含氮杂环配体。与金属离子的反应活性很高。因此MOFs的合成多采用一步法,即金属离子和有机配体自组装而成【11】。
- 配位能力可以改变。由于路易斯酸和金属离子的静电效应。配体中的官能团和配体性能可以灵活地改变。金属离子有两个作用,作为骨架的顶点既可以提供中枢又可以在中枢形成分支。通过这两个作用,骨架得到延伸,从而形成多维结构【12】。
- MOFs不仅具有多孔性,而且孔的形状还具有多样性。 这主要是由有机配体的结构和形状决定的。通过选择适宜的结构和形状的有机配体就可以控制合成的MOFs的孔的结构和大小。从而控制骨架的孔隙率和比表面积,得到适宜不同应用要求的多孔材料【13】。
- MOF具有不饱和金属配位,MOFs在合成过程中,由于空间位阻等原因。金属离子除了与大的有机配体配位以外。还会结合一些小的溶剂分子来满足其配位数的要求,如水、乙醇、甲醇、DMF等。另外,这些小分子有时还以弱相互作用(多为氢键)的形式与有机配体相结合【14】。
- MOF具有结构的多样性。金属离子和有机配体的配位能力之间存在很多多样性,从而就决定了MOFs的结构多样性。由于不同金属离子的配位数不同。并且相同的金属离子有时在不同的配位环境中也会出现不同的配位数。有机配体更是多种多样,其结构更是丰富多样的【15】。
- MOFs的结构还受到很多其它因素的影响。例如,选择不同的合成条件也可能会获得不同结构的骨架。
1.3.3 MOF材料在药物传递系统中的应用
目前,制约药物传递系统发展困难的主要原因之一就是载药量低。但是由于MOFs具有高度的多孔性和其内部拥有亲水亲油基团,可以实现较高的载药量。此外,MOFs可在非常广泛的范围内选择不同有机配体与各种金属离子进行络合。因此,将其用作于药物载体时,可根据药物的特异性质,从而设计出具有不同孔道结构大小和化学特性的金属-有机骨架。
药物传递应用中MOF的早期研究集中在气态药物分子的存储和传播。随着研究的不断深入,研究者们发现MOF的孔径可以调整,化学修饰过程很容易。由于MOFs的框架构成是由不同链接数的有机配体(联结桥)和金属离子结合而成,合适的支架可以带来增加渗透和保留的作用(EPR),以及肿瘤特异性,可调性药代动力学,最终减轻化疗副作用等优点。后合成修饰可以作为实现MOFs的附加功能的良好选择。前瞻性研究表明,通过MOFs的表面修饰可以在基于MOF的DDS中实现按需药物释放,这些优点使MOF成为治疗癌症的通用平台,在药物传递系统中的运用发展前景广阔。
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示:


课题毕业论文、开题报告、任务书、外文翻译、程序设计、图纸设计等资料可联系客服协助查找。



