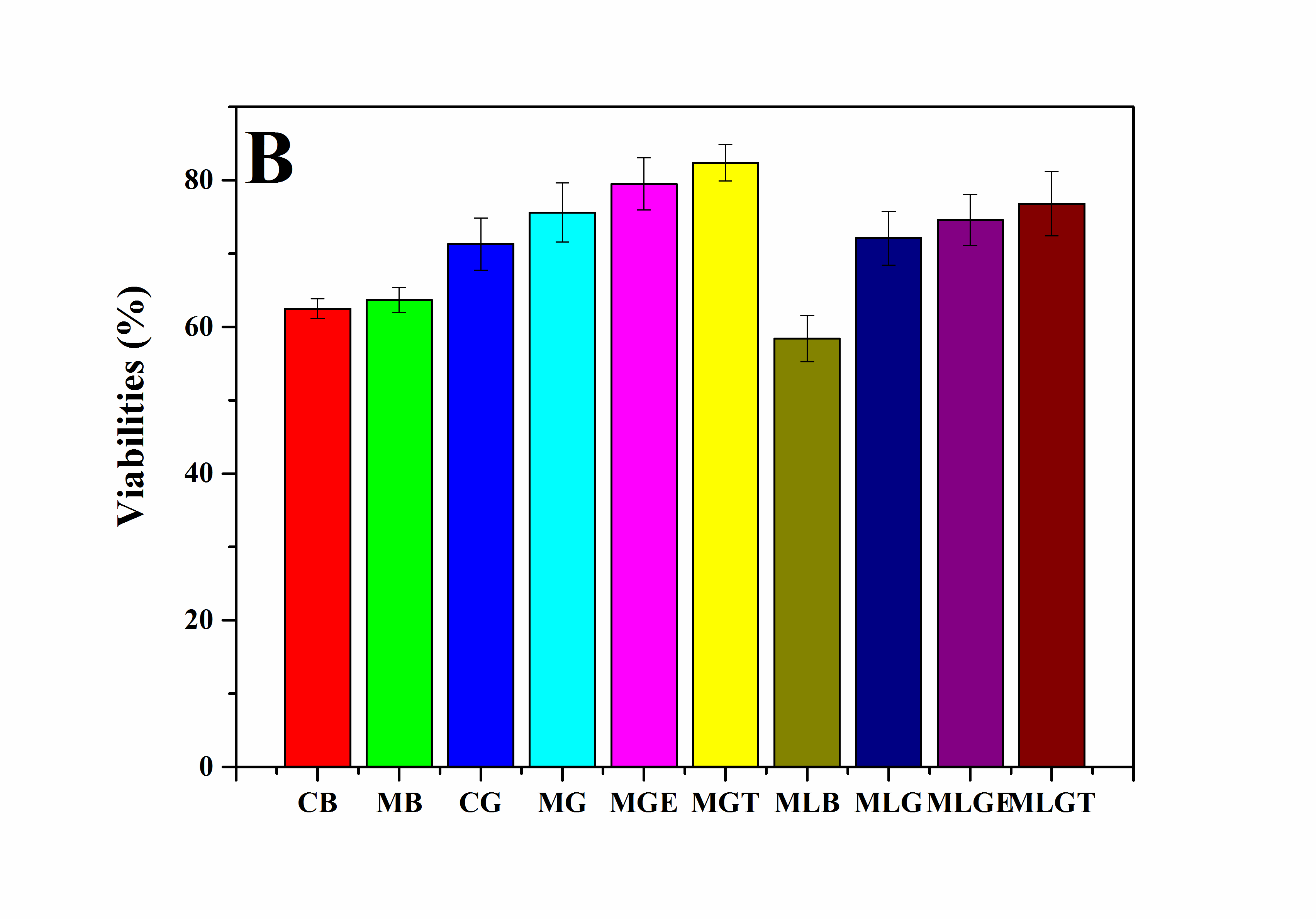利用微通道受限空间构建超分子凝胶低温冻存体系毕业论文
2020-04-08 12:43:42
摘 要
近年来,随着生物学和临床医学等学科的飞速发展,在科学研究上对于高质量、高活性的活细胞的需求日益增加,如何实现活细胞的长期储存是目前科学家们所面临的最主要的挑战之一。传统的细胞储存的方法是通过低温冻存,然而这种储存方法会给细胞带来冰晶损伤、渗透压损伤以及冻存保护剂的毒性损伤等。因此,本文设计了一种新型的超分子凝胶体系,可以通过在细胞培养基中添加小分子凝胶因子,使其自组装形成具有三维网状结构的超分子凝胶,从而起到在低温冻存过程中保护细胞的作用,有效地降低了细胞的冻存损伤,实现了细胞存活率和活性的提高。此外,本文还利用了微通道作为细胞冻存的存储空间,微通道所提供的受限空间使超分子凝胶的三维网状结构变得更加紧密,从而提高了超分子凝胶对细胞的保护作用。本文的具体研究内容如下:
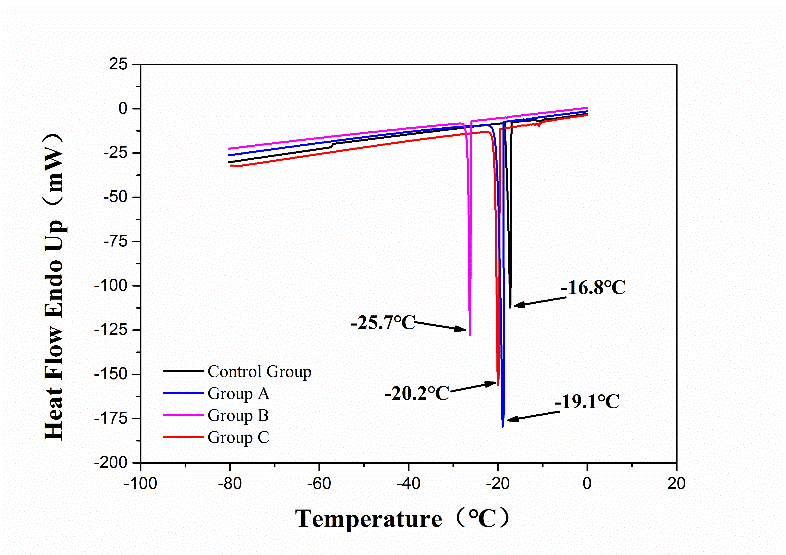
1.合成了一种氨基酸衍生物类的凝胶因子BDT,并且检测了该凝胶因子在RPMI1640培养基中形成的超分子凝胶(BDTC)的形貌和性能。研究结果表明,BDTC超分子凝胶具有三维网状结构并具有热可逆性,当温度低于凝胶化转变温度时,BDTC超分子凝胶是凝胶态,而在高于凝胶化转变温度时,如37℃时,该凝胶又可以转变为液态。通过DSC测试发现,BDT的加入能明显降低低温冻存体系的冰点,这对于降低冰晶损伤具有重要意义。
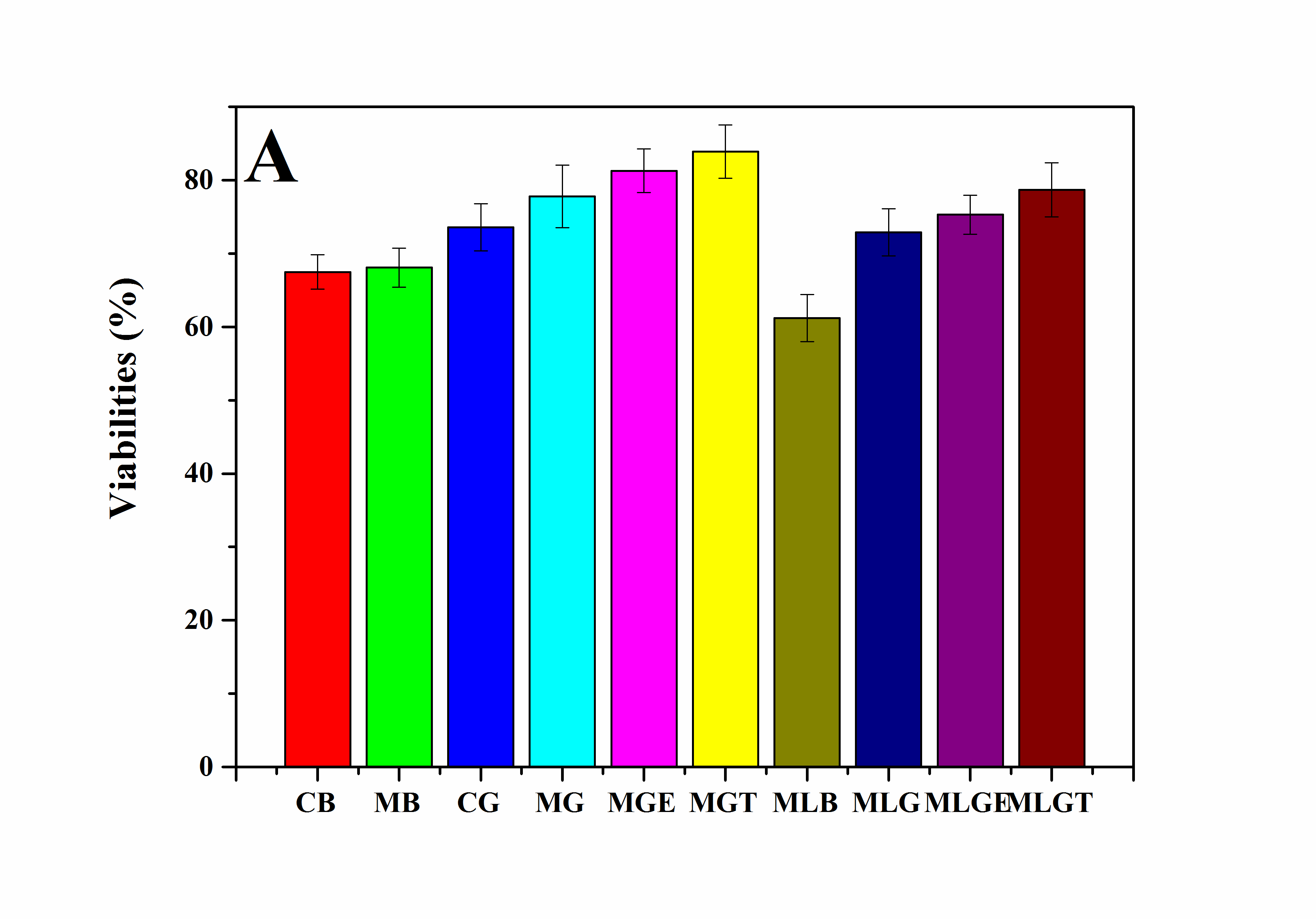
2. 以RSC96细胞为模型细胞,研究了超分子凝胶低温冻存体系在冻存管中的冻存效果。研究结果表明,当凝胶因子被添加在细胞培养基中后,被冻存的细胞在复温后的存活率和活性都有较明显的提高。
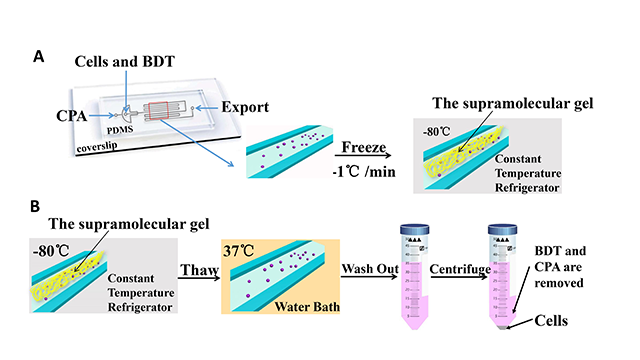
3. 以聚二甲基硅氧烷(PDMS)为原料,通过软刻蚀技术制备微通道。研究结果表明,在微通道中形成的超分子凝胶三维网络结构较冻存管中的结构更加紧密,并且微通道的使用可以降低冻存保护剂DMSO的浓度,从而进一步提高超分子凝胶低温冻存体系的低温保护效果。
关键词:凝胶因子,超分子凝胶,微通道,细胞,低温冻存
Abstract
In recent years, with the rapid development of biomedicine and clinical medicine, the
demand for living cells with high quality and high vitality has increased. The method to realize the long-term storage of living cells is one of the main challenges. The traditional cell storage method is cryopreservation. However, this storage method may cause ice crystal injury, osmotic pressure injury, and toxic injury. Therefore, a novel supramolecular gel system was designed in this paper. When the gelator is added to the cell culture medium, it can self-assemble to supramolecular gels with a compact three-dimensional network structure. The supramolecular gels will reduce the cell injury and increase the cell viability during the cryopreservation process. In addition, the microchannels are used to conduct the cell cryopreservation, and the confined space provided by the microchannels makes the three-dimensional network structure of the supramolecular gel more compact. The use of the microchannels can better protect the cells and reduce the concentration of cryoprotectants. The specific experiments are as follows:
1. The synthesis of the gelator BDT which was an amino acid derivative. The morphology and properties of the supramolecular gel formed in the RPMI 1640 medium were examined. When the temperature was lower than the gel transition temperature, the BDTC supramolecular gel would form, and when the temperature was above gel transition temperature, such as 37 ℃, the gel would transform into liquid again. According to the DSC assay, the results showed that the adding of BDT reduced the freezing point of the cryopreservation system, which was of great significance for reducing ice crystal injury.
2. The RSC96 cells were used as model cells. The results showed that when the gelator was added into the cell culture medium, the survival rate and viability of the thawed cells had a significant increase.
3. The polydimethylsiloxane (PDMS) was used and the microchannel was fabricated by soft lithography technology. The results showed that the supermolecular gel formed in the microchannel became more compact. And the use of microchannels could reduce the concentration of cryoprotectant DMSO. Therefore, the use of microchannels could further improve the protection effect of cryopreservation system.
Key Words:Gelator,Supramolecular gel,Microchannel, Cell, Cryopreservation.
目录
第一章 绪论 1
1.1细胞的低温冻存 1
1.1.1 冻存保护剂 1
1.1.2低温冻存技术 2
1.2 超分子凝胶 3
1.2.1 水凝胶 3
1.2.2 超分子凝胶 3
1.3 微流控技术 4
1.4 本文的目的和内容 5
第二章 超分子凝胶的制备和性能研究 6
2.1 引言 6
2.2 主要试剂及仪器说明 6
2.2.1 主要试剂 6
2.2.2 主要仪器 7
2.3 超分子凝胶的制备 7
2.4 微通道的制备 8
2.5 超分子凝胶的形貌 8
2.6 超分子凝胶的热学性能 8
2.7结果与讨论 9
2.7.1超分子凝胶的形貌分析 9
2.7.2超分子凝胶的热学性能分析 10
第三章 构建超分子凝胶低温冻存体系 12
3.1 引言 12
3.2 主要试剂及仪器说明 12
3.2.1 主要试剂 12
3.2.2 主要仪器 13
3.3 细胞的低温冻存 13
3.3.1 细胞在冻存管中的低温冻存 13
3.3.2 细胞在微通道中的低温冻存 13
3.4 细胞的冻存效果测试 14
3.4.1台盼蓝拒染实验 14
3.4.2荧光染色实验 15
3.4.3 MTT实验 15
3.5 结果与讨论 16
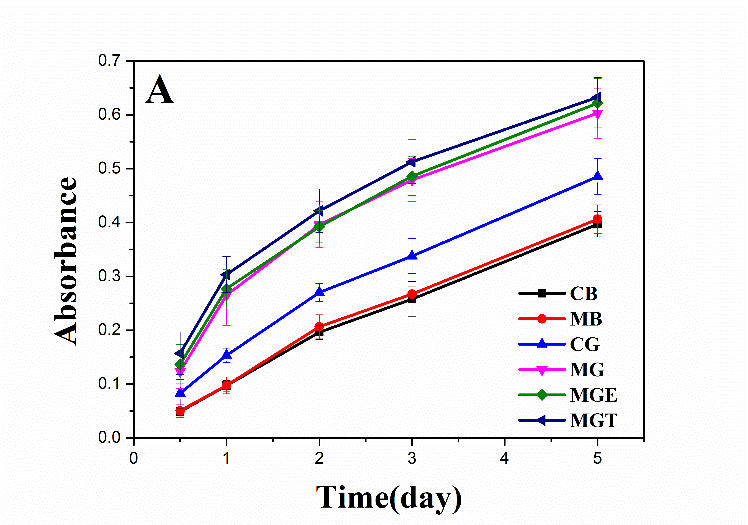
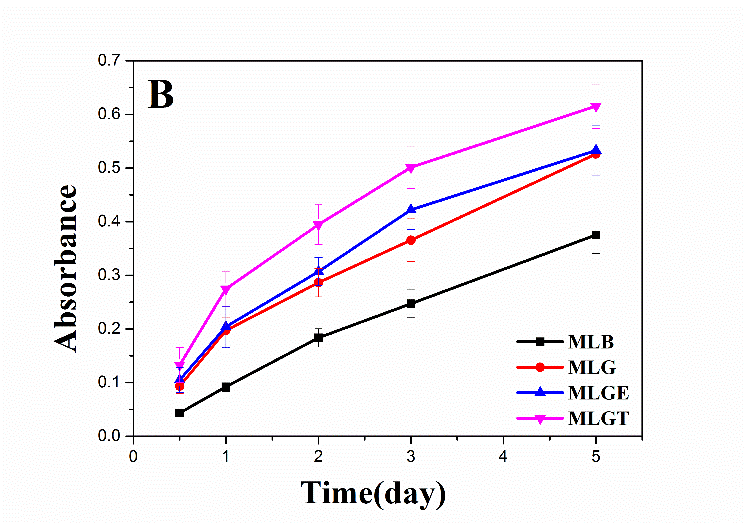
3.5.1复温后细胞的活性检测 16
3.5.2复温后细胞的MTT检测 19
第四章 总结 22
参考文献 24
致 谢 28
相关科研成果目录 29
第一章 绪论
1.1细胞的低温冻存
随着生物技术的发展,如何保证大量高活性的细胞持续有效供应是研究人员目前面临的主要问题之一,细胞的长期储存对我们来说是一个巨大的挑战,对于细胞移植和生物器官研究等具有重要意义。[1-2]目前,细胞的主要储存方法是低温冻存,这是一种在低温下储存细胞、组织或其他物质的技术。[3-4] 低温冻存技术在许多生物学领域如现代医学和低温生物学中具有非常重要的意义。[5-6]
1.1.1 冻存保护剂
在低温冻存中,通常会将冷冻保护剂(CPA)添加到低温冻存体系中,因为它们可以在冷冻和解冻的过程中起到保护细胞的作用,并提高复温后细胞的存活率。 多年前,英国的科学家在低温冻存精子和红细胞时发现了甘油的加入可以有效的提高细胞的存活率,自此以后冻存保护剂就慢慢发展了起来。冻存保护剂的作用主要是当它在低温冻存过程中被加入到培养基中后,它可以降低电解质的浓度,缓解细胞内外渗透压的变化,从而起到保护细胞的作用。CPAs包括渗透性的冷冻保护剂(PC)和非渗透性的冷冻保护剂(IPC)。[7] PCs可以渗入细胞,如二甲基亚砜(DMSO)、乙二醇(EG)。它们可以与细胞中的水分子结合并降低细胞外电解质溶液的浓度,同时降低了细胞内水的含量,减少了细胞内冰晶的形成。二甲基亚砜(DMSO)是最常见的冻存保护剂,在低温冻存细胞时,如果DMSO浓度太低则不会起到保护细胞的作用,如果DMSO浓度太高,细胞又会因为其毒性而被损伤。
IPCs不能进入细胞,如海藻糖、聚乙二醇(PEG)。[8] 这些物质往往可以溶解在水中,但是不会进入细胞内部,其作用机理为在细胞的表面形成一层保护膜,同时降低冰点,减少细胞外冰晶的形成。当它们与渗透性冻存保护剂一起使用时,渗透性冻存保护剂的保护作用会被增强并且浓度会降低。例如,Gao[9]的研究小组使用1.5M二甲基亚砜(DMSO)在CPTES溶液中(一种平衡盐溶液,其组成与细胞内液相似,并用100mM N-三(羟甲基)甲基-2-氨基乙烷磺酸作为缓冲剂)作为冷冻保护剂低温冻存兔颈动脉,他们发现兔颈动脉在冻存1年后仍保持相对较高的通畅率。但在实际的储存过程中,由于细胞内冰晶和细胞外冰晶的形成和生长,渗透压的剧烈变化,解冻过程中冰晶的再结晶和CPAs的毒性,传统的低温冻存技术会破坏细胞结构,诱导细胞脱水并导致细胞渗透损伤。[10-11]
1.1.2低温冻存技术
常用的低温冻存技术主要有两种:程序化慢速冻存和玻璃化冻存。[12]程序化慢速冻存技术是将冻存保护剂添加到细胞培养液中,然后采用特殊的方法在一定的降温速率下将细胞冷却至低温,使得细胞内的一切新陈代谢被低温所抑制,细胞的活性保持不变,从而实现细胞的长期储存;而在细胞或组织需要被使用时,通过特殊的方法将低温冻存体系加热至正常生理温度并去除体系中的冻存保护剂,此时,细胞或组织的生物学功能即可恢复正常。
程序化慢速冻存技术主要包括五个基本步骤:(1)通过一步法、阶梯法等方法进行冻存保护剂的添加;(2)在恒定的降温速率下将低温冻存体系冷却至低温;(3)保持低温状态进行细胞或组织等的长期储存,通常选择在液氮中进行;(4)在需要使用时,将冻存的细胞或组织等通过特殊的方法升温至正常的生理温度(37℃);(5)通过特殊的方法进行冻存保护剂的脱除。马学虎等[13]通过程序化慢速冻存的方法进行了神经干细胞的低温冻存,并且检测了复温后细胞的的存活率和诱导分化情况,实验结果表明当冻存保护剂DMSO 的浓度在8%时,程序化慢速冻存具有最佳的效果,此时复温后的细胞具有最高的存活率和最强的生长增殖能力。
玻璃化冻存技术也称为快速冷却非晶态固化法,它主要是通过超快速降温,在极短时间内使得细胞及其外部材料直接进入玻璃态,从而实现细胞的长期低温冻存。玻璃化冻存技术通常也有五个步骤:(1)添加冻存保护剂;(2)将低温冻存体系快速冷却至玻璃态;(3)在低温的状态进行细胞或其他材料的长期储存;(4)在需要使用时,将细胞或其他材料通过特殊的方法升温至正常生理温度(37℃);(5)进行冻存保护剂的脱除。葛斌等[14]在不使用冻存保护剂的条件下进行了经皮附睾抽吸精子(PESA)的玻璃化冻存,实验结果表明在不使用冻存保护剂的条件下进行玻璃化冷冻可以避免PESA所受的冰晶损伤以及冻存保护剂对精子的毒性损伤, 但是在实验过程中PESA会与液氮直接接触,可能导致交叉感染。
虽然常用的低温冻存技术可以实现细胞的低温冻存,但是当前的两种低温冻存技术都会对细胞产生不同程度的损伤。例如冰晶损伤、溶液损伤、复温过程中再结晶带来的损伤等。虽然添加冻存保护剂一定程度上能降低上述损伤,但是冻存保护剂添加和脱除过程中会造成细胞的体积收缩和脱水,超过其允许上限时可能导致细胞损伤,而一些冻存保护剂如DMSO本身具有细胞毒性。而且玻璃化冻存技术对于实验设备的要求非常苛刻,操作条件极为严格,实验过程十分复杂,这不利于实现细胞的大规模低温冻存。
1.2 超分子凝胶
1.2.1 水凝胶
水凝胶是以水为分散介质的凝胶。它是一种交联聚合物,具有网络状的结构,柔软可形变,能吸收大量的水。水凝胶可分成物理凝胶和化学凝胶。物理凝胶是通过静电作用、氢键、链的缠绕等形成的,这种凝胶是非永久性的,它可以在加热的条件下转化为溶液,所以它也被称为假凝胶或热可逆凝胶。许多天然高分子在常温下呈稳定的凝胶态,如琼脂等;在合成聚合物中,如聚乙烯醇(PVA)经过冰冻融化处理,在60℃下可形成稳定的水凝胶。化学凝胶是由化学键交联而成的永久性凝胶,所以又被称作真凝胶。水凝胶由于形状大小各不相同,所以又有宏观凝胶和微观凝胶的区别,宏观凝胶可细分为柱状、、纤维状、球状等凝胶,微观凝胶存在微米级及纳米级凝胶之分。传统的水凝胶对外界的变化不敏感,而环境敏感型水凝胶能检测外部环境(如温度、pH等)的变化,并能发生相对应的物理结构或是化学性质的改变。
近年来,水凝胶由于其具有良好的生物相容性,越来越被认可是一种优质的软物质材料,在临床医学、日常用品和细胞的低温冻存等多个领域广泛使用。[15-17] 如面膜、石油产品中的堵水调剂,采矿中使用的粉尘抑制剂,食品防腐剂、增稠剂和医用的药物载体等。由于水凝胶的来源丰富,成本低廉,越来越多的学者正致力于水凝胶的改性和应用。例如,在细胞的低温冻存过程中,水凝胶可以用于封装细胞以形成微胶囊,这种微胶囊可以让小分子的营养物质透过细胞膜,同时阻碍大分子物质的进入,进而有利于降低细胞损伤。海藻酸盐形成的水凝胶具有良好的生物相容性和渗透性能。Paulraj Kanmani等[18]利用海藻酸盐-壳聚糖凝胶包裹益生菌细胞,结果显示,由于凝胶的三维网络结构的保护作用,在六个月内链球菌细胞在-20°C下存活的更好并且具有更高的细菌素活性(5.468 ± 0.15 Log CFU / mL)。陈万煜等[19]利用含荧光氧敏性染料的海藻酸盐水凝胶微胶囊去封装单个大鼠胰岛,这些微胶囊可以通过单个胰岛的氧耗率(OCR)来检测低温冻存的效果。尽管水凝胶具有许多可用于低温冻存的优点,但目前最大的问题是水凝胶膜难以在不损伤细胞的情况下被除去,例如在去除水凝胶膜的过程中,往往需要加入乙二胺四乙酸(EDTA),柠檬酸三钠或其他试剂。[20]
1.2.2 超分子凝胶
近年来,凝胶因子由于其固有的热可逆性和可生物降解的能力而引起了各个生物、医学等领域的高度关注。凝胶因子是一类小分子有机物,它能以很低的浓度使溶剂凝胶化。凝胶因子可以通过自组装形成三维网络状结构,并且它们通过分子间作用力例如氢键、范德华力、π相互作用、配位、供体-受体以及各种溶剂中的电荷转移相互作用形成超分子凝胶。[21]大多数凝胶因子来源于脂肪酸、多肽、类固醇、氨基酸及其衍生物、碳水化合物及其衍生物等。凝胶因子的种类主要可以分为:(1)长链烷烃或氟碳化合物;(2) 氨基酸类衍生物;(3)ALS 类衍生物;(4)糖类衍生物;(5)芳香族衍生物;(6)有机金属化合物;(7)脲类衍生物。氨基酸衍生物类的凝胶因子使用最为广泛,由它自组装得到的超分子凝胶生物相容性良好,并且具有刺激响应性和可逆性。人们发现这种凝胶因子不仅可以形成凝胶结构而且可以促进药物渗透入皮肤,十分适合应用于药物的靶向运输。氨基酸衍生物类的凝胶因子目前在生物领域作为组织工程的支架,生物矿化的基质,伤口愈合的敷料以及药物运输的载体等方面实现了广泛的应用并且依然具有远大的前景。
超分子凝胶是由凝胶因子通过氢键、范德华力等分子间作用力自组装而成的。[22-23] 其中氢键在凝胶因子自组装形成超分子凝胶的过程中是最为常见和最为重要的驱动力。因为非共价相互作用具有可逆性并且相互作用力较弱,因此超分子凝胶对环境的变化如pH、温度等变化能快速做出响应并且变化过程是可逆的。此外,超分子凝胶一般具有三维网状结构,具有良好的生物相容性和可生物降解的能力。因此,超分子凝胶已广泛应用于生物医学、细胞工程和药物运输等领域。[24-25] 目前,大多数学者研究的超分子凝胶多为响应性超分子凝胶。由于这种超分子凝胶在受到外界环境的变化时性质会发生可逆改变,这使得它在药物的控制和释放以及智能材料等领域具有广阔的发展前景。然而,在关于低温冻存领域使用超分子凝胶的研究却很少。曾杰等人[26]发现超分子凝胶可以降低神经细胞在低温冻存过程中受到的损伤,因为超分子凝胶可以降低CPAs的渗透速率,降低渗透压的变化速率和冰晶损伤。此外,超分子凝胶在解冻过程中可以转化为液态从而容易被除去。
1.3 微流控技术
微流控技术在近年来广泛应用于生物储存[27-29]、细胞诊断[30-31]和药物运输[32-34]等多个领域。微流控技术是通过特定的注射装置以一定的流速将样品注射入微通道中,由于微通道可以提高特定的受限空间,与一般的分析技术相比,微流控技术的优点如下:首先,它可以灵活准确地控制微通道中体积在纳升或皮升的流体。其次,微流控技术的分析速度快,检测灵敏度高,每次实验所需的样品和试剂用量很少。此外,由于微通道具有适合细胞的宽度和大小,因此可以在微通道内创建一个适合细胞体外培养的微环境。通过软刻蚀技术制作的微通道因其透光性好,所以常常用于在显微镜下实时观测和记录尺度在微米或纳米级的物质的形貌,为实验的理论分析提供数据。
目前,微流控技术已经成为一种重要的分析手段并成功运用于细胞分类、计数等领域。Eric Brouzes等[35]利用微流控技术设计了一种液滴微流体平台,这种平台可以将单细胞和试剂封装在分散的不混溶的载油独立水微滴中,并且能够以非常高的吞吐量对这些物质进行数字操作,实验结果表明这种微流体平台可以实现高通量单细胞分析、组合筛选和促进小样本分析。虽然微流控技术在细胞低温冻存中尚无临床应用,但是随着微流控技术的进一步普及,相关研究报道也在不断增多。[36-38] 邹玉洁等[39]利用微通道完成了无冷冻保护剂的人类精子的超快速低温冻存并且人类精子的生理参数几乎不受低温冻存的影响。
1.4 本文的目的和内容
微通道所提供的受限空间可以调节超分子凝胶的网络结构。[40] 然而,根据查阅的报道和参考文献,在微通道中制备超分子凝胶并应用于低温冻存领域的研究几乎没有。因此,本文在微通道中制备了一种新型的超分子凝胶(BDTC)低温冻存体系以减少细胞损伤。本文使用了RSC96细胞作为实验细胞,并且发现微通道的使用可以使BDTC超分子凝胶的微结构更加紧密,因此复温后的RSC96细胞的细胞存活率增加了。此外,本研究还发现多组分低温冻存体系比单组分低温冻存体系具有更好的保护作用。
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示:
课题毕业论文、开题报告、任务书、外文翻译、程序设计、图纸设计等资料可联系客服协助查找。