不同纳米氧化铁对植物幼苗的生理生化影响毕业论文
2020-04-08 13:25:26
摘 要
纳米材料的广泛使用最终会导致大量纳米粒子释放到环境中,从而在一定程度上会对生态环境和人类健康造成威胁。于是近几年来,关于纳米材料对生态系统的影响的关注度日趋增加。本研究评估了多种纳米氧化铁在水培条件下对小麦种子萌发及幼苗生长发育的影响。同时对比适宜浓度的EDTA-Fe,Fe2 和Fe3 对小麦幼苗生长发育的影响。通过对小麦幼苗的生物量、抗氧化体系、叶绿素、根系活力等进行检测,探究纳米氧化铁以及其它多种存在形式的铁对小麦早期生长阶段的生物效应及植物毒性。结果表明,不同处理下的小麦幼苗的Fe含量、抗氧化酶活性、MDA和可溶性糖含量都有变化,其中Fe2 和Fe3 处理的小麦幼苗的抗氧化酶活性等都大于纳米粒子处理。同浓度处理下,纳米材料处理的小麦幼苗展现了比离子处理更小的生物毒性,而且经纳米材料处理的小麦幼苗中的Fe含量更高。
关键词:水培,纳米氧化铁,小麦,发芽,生长
Abstract
It is estimated that the widespread use of nanomaterials will eventually lead to the release of a large number of nanoparticles into the environment, thus threatening the ecological environment and human health to a certain extent. Therefore, in recent years, attention has raised on the influence of nanomaterials on ecosystems. In this work, we evaluate the effects of optimal concentrations of various nano-iron oxides on wheat’s the growth and development under hydroponics cultivation and the physiological effects of nanoparticles on the germination of wheat seeds. At the same time, We compared the effects of EDTA-Fe, Fe2 and Fe3 with nano iron oxides on wheat growth and development, exploring the toxic effects of nano iron oxides and other forms of iron on the early growth stage of wheat.
The results show that the plant growth, the content of chlorophyll and malondialdehyde (MDA) the activity of antioxidant enzymes (SOD, CAT, POD, APX) were altered in wheat plants at all treatments. Nano iron oxide, even at the same concentration of iron ions, is less toxic to wheat seedlings under the experimental conditions.
Key words: Hydroponics, Nano-iron oxide, Wheat, Germination, Development
目录
第1章 绪论 1
1.1研究背景和意义 1
1.2纳米氧化铁 2
1.3研究目的与内容 2
1.3.1研究目的 2
1.3.2研究内容 3
第二章 实验材料和方法 4
2.1小麦种子的萌发及幼苗的培养 4
2.1.1 实验试剂 4
2.1.2仪器设备 5
2.1.3 小麦幼苗的萌发及萌发实验处理 5
2.2水培处理 6
2.2.1小麦营养液配方 6
2.2.2处理液的配置 6
2.2.3根灌处理方法 7
2.3 小麦叶片各生理指标的测法 8
2.3.1叶绿素含量的测定 8
2.3.2可溶性蛋白含量的测定 8
2.3.3丙二醛(MDA)含量的测定 9
2.3.4超氧化物歧化酶(SOD)活性的测定 9
2.3.5过氧化物酶(POD)活性的测定 11
2.3.6过氧化氢酶(CAT)活性的测定 11
2.3.7抗坏血酸过氧化物酶(APX)活性的测定 12
2.4数据统计方法 13
第三章 结果与分析 14
3.1小麦各生理指标的分析 14
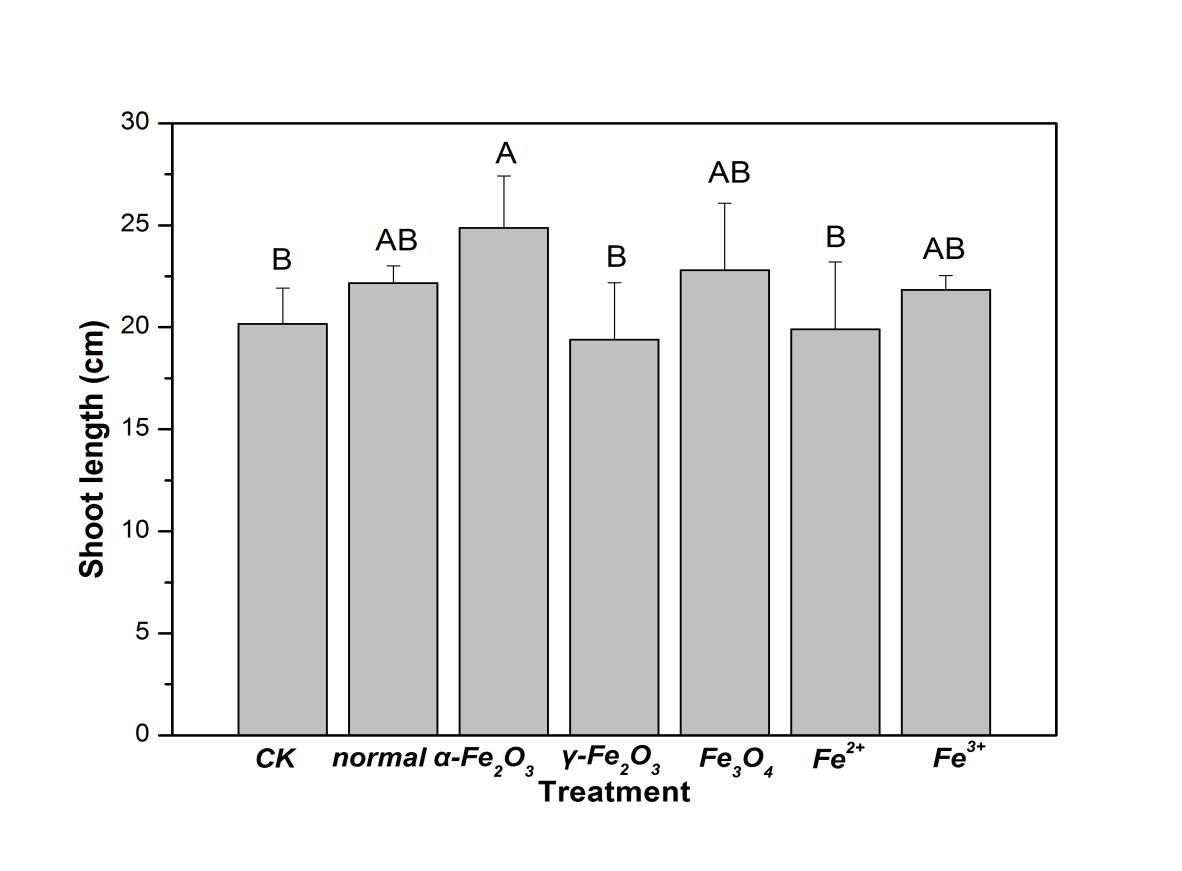
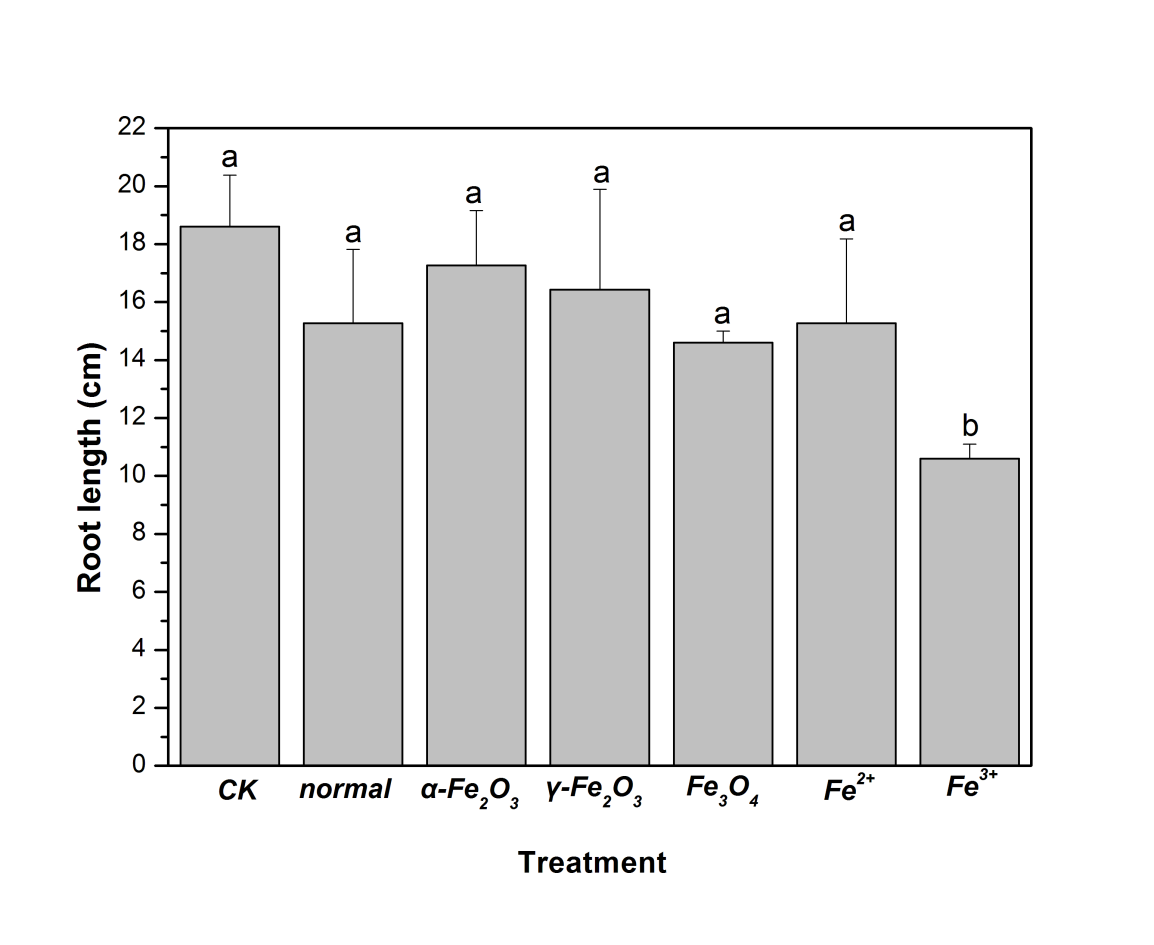
3.1.1 种子萌发和植株伸长的分析; 14
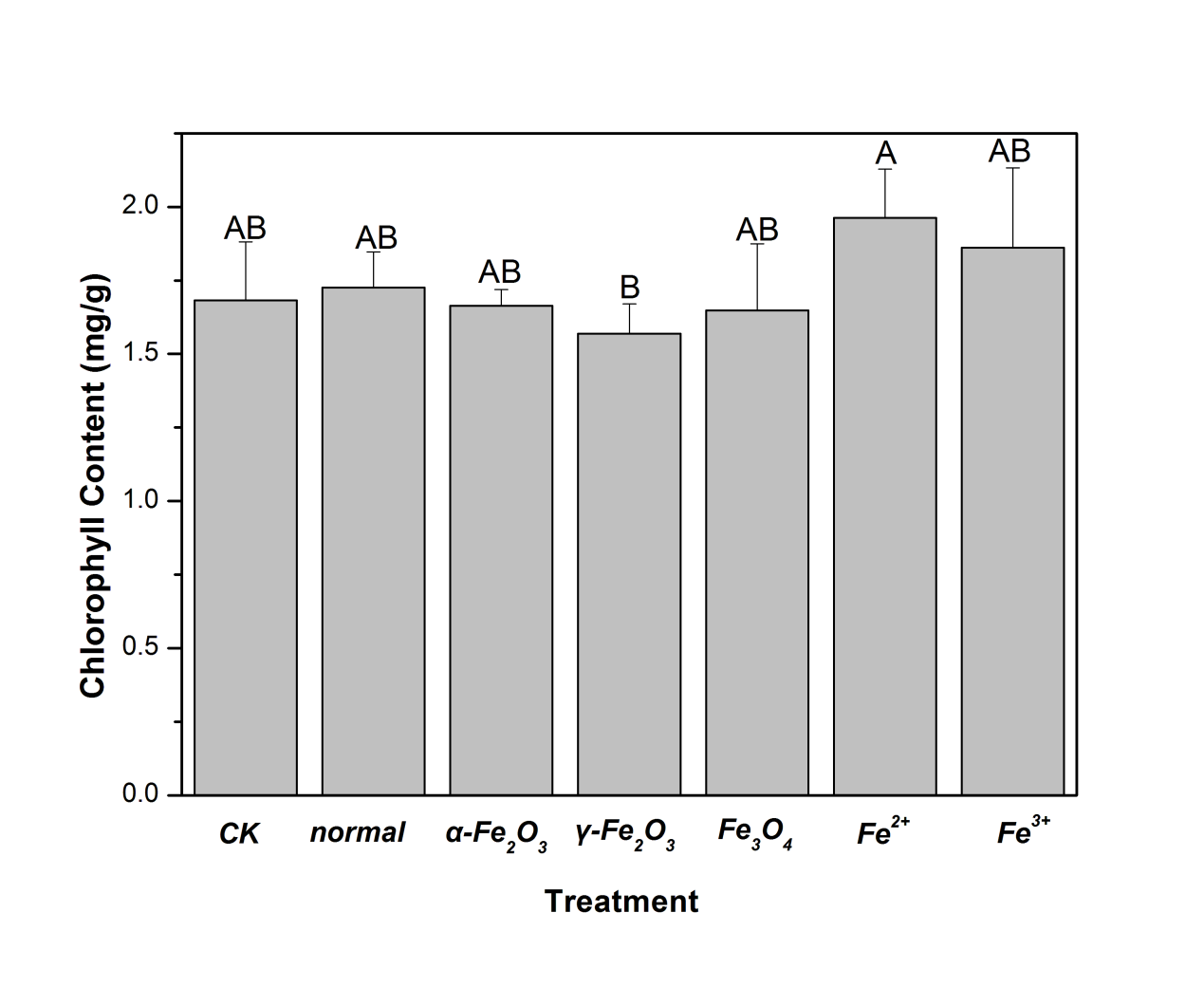
3.1.2叶绿素含量的分析 17
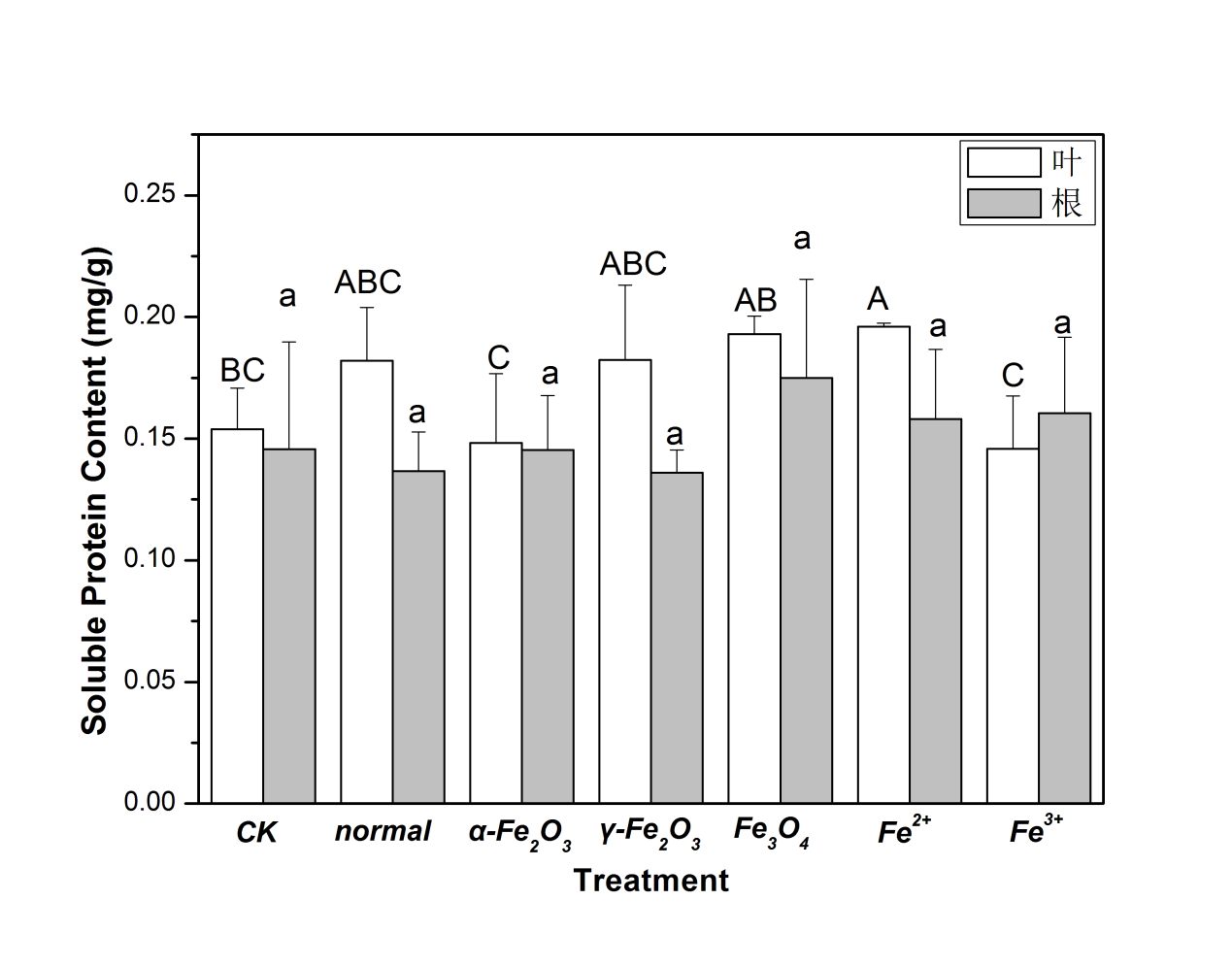
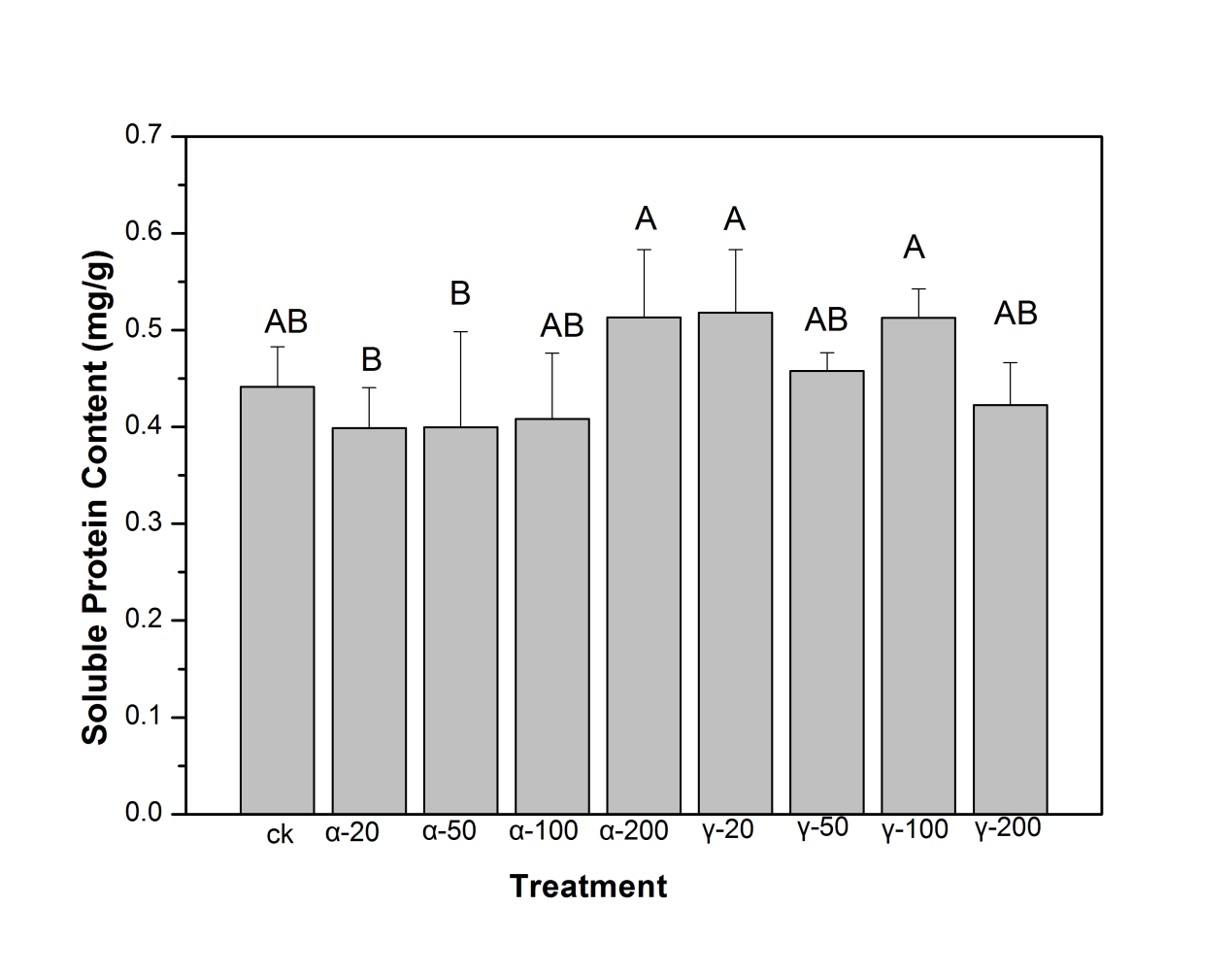
3.1.3可溶性蛋白含量的分析 18
3.1.4可溶性糖含量的分析 20
3.1.5丙二醛(MDA)含量的分析 22
3.1.6抗氧化酶活性的分析 24
3.1.7 铁含量的分析 32
3.2小结 33
第四章 结论 34
第1章 绪论
1.1研究背景和意义
现如今纳米材料广泛使用,纳米颗粒(NP直径1-100纳米)材料的增加导致纳米材料大量释放到环境中,引起了严重的生态健康和人类健康问题。不同的纳米材料在生物和其他工业上的使用同样也越来越多,因此有必要深入了解这些纳米材料对生物细胞潜在的不利影响,因为它们可以借助于水介质进行运输并积累在土壤中[ 1-2]。物是食物链中重要的组成成分,食物原料不仅是营养物质的来源而且与消费者的健康息息相关,植物可能将纳米粒子运送到食物链中,最终纳米粒子可能会对人类和动物的健康构成威胁。关于纳米粒子在植物中吸收,转运和毒性的报道很多,但表现出的结果有些矛盾,根据使用的纳米粒子,它们的大小和植物种类不同而有所不同[2-8]。 Zhu等人首次在植物中使用Fe3O4纳米颗粒进行了研究[9],他们证明南瓜植物对这些类型的纳米粒子有显着的吸收作用,并且随后在各种组织中发生了转运和积累。据报道,在大豆植物中,氧化铁纳米粒子影响叶绿素含量,并可能影响光合作用反应不同阶段的生化反应和酶促效率[10]。尽管大多数纳米粒子比植物细胞壁孔(3.5-5nm)具有更大的尺寸[11],但已经表明它们可以通过不同机制进入植物根细胞,包括水孔蛋白[12],内吞作用[13],膜转运系统[14-15],通过与环境介质中的载体蛋白或有机化学物质结合[16],通过细胞壁组分的交联产生新的孔[17]。根据纳米粒子的类型,它们可以在根中累积或通过木质部或韧皮部转运到其他组织[18]。纳米粒子在细胞间的运动可以通过胞间连丝发生,并且在细胞内部,它们还可以通过内细胞胞吐作用或通过质外体和质体转运[19-21]。有人提出维管组织可能在纳米粒子长距离传输过程中发挥重要作用[22],正如CuO纳米颗粒的机制一样,这些颗粒在植物木质部中被木质部向上运输,通过韧皮部向下运输[23]。然而,需要进一步研究以了解不同纳米粒子在几种植物物种中的吸收,运输和影响的作用机制。通常认为磁铁矿纳米粒子是生物化学惰性的[8]。由于它们的磁性特性而用于成像和分离技术,以及这些纳米粒子可以涂上催化剂或酶,以获得具有双重功能的纳米粒子:分离和检测[25]。此外,Fe3O4纳米颗粒越来越多地用于生物医学领域[26-27]和环境修复领域[28-30]。在这样的研究背景条件下,这项工作的目的是为了确定纳米氧化铁是否对小麦种子发芽和幼苗生长的早期阶段具有毒性作用,以便在这个关键阶段避免潜在的毒性效应。
1.2纳米氧化铁
纳米材料指尺寸在于1纳米到100纳米范围之间材料。由于纳米材料的大小与电子的相干长度尺寸相近,导致纳米材料的性质发生很大的变化,有了很多新功能。而且纳米材料的尺度也与光的波长尺度相近,加上其又同时具有大比表面积而具有的特殊效应,所以其所表现出很多的特性,比如像纳米材料的磁性、特殊的熔点、特殊的导热、特殊光学以及导电特性等,这些特性往往同这种物质在非纳米尺寸时所展现出来的性质在一定程度上有所不一样。
纳米粒子相比其他类型的材料具有许多优越的性能。如高矫顽力、超顺磁性、高磁化率、低居里温度[31]等,磁纳米粒子引起了很多学科研究者的兴趣,包括数据存储、磁流体、生物应用和催化应用等方面。特别是数据存储和铁磁的应用研究,导致目前在许多商业上都开始应用磁性纳米粒子。目前,磁性纳米粒子还能用于重要的生物应用领域,包括生物实体检测(核酸、蛋白质、酶、病毒、细菌、细胞)等和磁分离、临床诊断和治疗(如核磁共振)、靶向药物及生物标记等。其中磁性氧化铁纳米粒子有可能应用在体外诊断,并且它也是器件具有可调的化学和物理性能的关键和选择建筑的纳米结构材料[32]。
由于纳米氧化铁颗粒具有大的表面体积比,具有较高的表面能。因此纳米颗粒倾向于聚集在一起来降低其表面能,导致聚沉。此外,赤裸在外的氧化铁纳米颗粒具有很高的化学活性,并在空气中极易氧化(特别是磁铁矿),通常导致分散性和磁性损失。因此,合适的表面涂层和有效的保护方法的研发,来维持纳米氧化铁颗粒的稳定性是非常有必要的。这些方法包括接枝的有机小分子、有机分子或表面活性剂、生物分子和聚合物或无机层与涂层,如二氧化硅、非金属或金属元素、金属硫化物或金属氧化物。实际上,在有些情况下,加入保护层,不仅能去稳定氧化铁纳米粒子,也可以进一步使其功能化。
随着纳米技术的快速发展和近些年对纳米材料的研究,纳米氧化铁的使用也越来越广泛,那么对于散落于环境中的纳米铁对生态健康和人类健康就带来了一定程度的影响。因此研究其对植物生长发育的影响是极具意义的。
1.3研究目的与内容
1.3.1研究目的
现如今,纳米材料已广泛应用于各个领域,给人类的生活带来了不容忽视的影响。但是人们对纳米材料的认识仍然有限,纳米材料进入生命体后对生命体的影响及生理过程的研究还很少。植物作为环境中的重要组成成分很容易从环境中吸收并储存一些纳米粒子,尤其是农作物在食物链的传递中起重要作用。而人们通过食用这些农作物,就有可能会将纳米粒子摄入体内。作物能否吸收和储存纳米粒子以及纳米粒子是否会对作物造成一些不良影响便是纳米材料开发使用的重大问题。因而系统的研究纳米材料对不同植物生长发育的影响可以帮助更好的评估纳米材料的生物安全性。现如今对纳米材料在植物生长发育过程安全性评估研究还不系统,有待进一步研究。
1.3.2研究内容
实验一:小麦种子的萌发及幼苗的培养:
将小麦种子在适宜的温度、水份、氧气和pH等环境下进行萌发,在萌发过程中根据实际情况,随时调整各个因素。萌发成幼苗后,在适宜环境下施以适当营养培养。同时在种子萌发阶段使用不同浓度不同种类的纳米氧化铁对种子的萌发阶段进行浸泡处理。
实验二:使用不同种类的纳米氧化铁进行根灌处理小麦:
在幼苗缺铁培育到一定阶段后,根据实验设计要求使用不同种类的纳米氧化铁进行根灌处理,同时对比适宜浓度的EDTA-Fe,Fe2 和Fe3 对小麦幼苗生长发育的影响。
实验三:对不同施加方式下使用纳米氧化铁处理小麦后进行相关数据的测定和分析:
测量植物幼苗的植株生长、抗氧化系统、光合作用参数等生理特性变化,探讨植物幼苗对纳米氧化铁处理的生理响应机制。
第二章 实验材料和方法
2.1小麦种子的萌发及幼苗的培养
2.1.1 实验试剂
表2.1实验试剂

2.1.2仪器设备
表2.2仪器设备
2.1.3 小麦幼苗的萌发及萌发实验处理
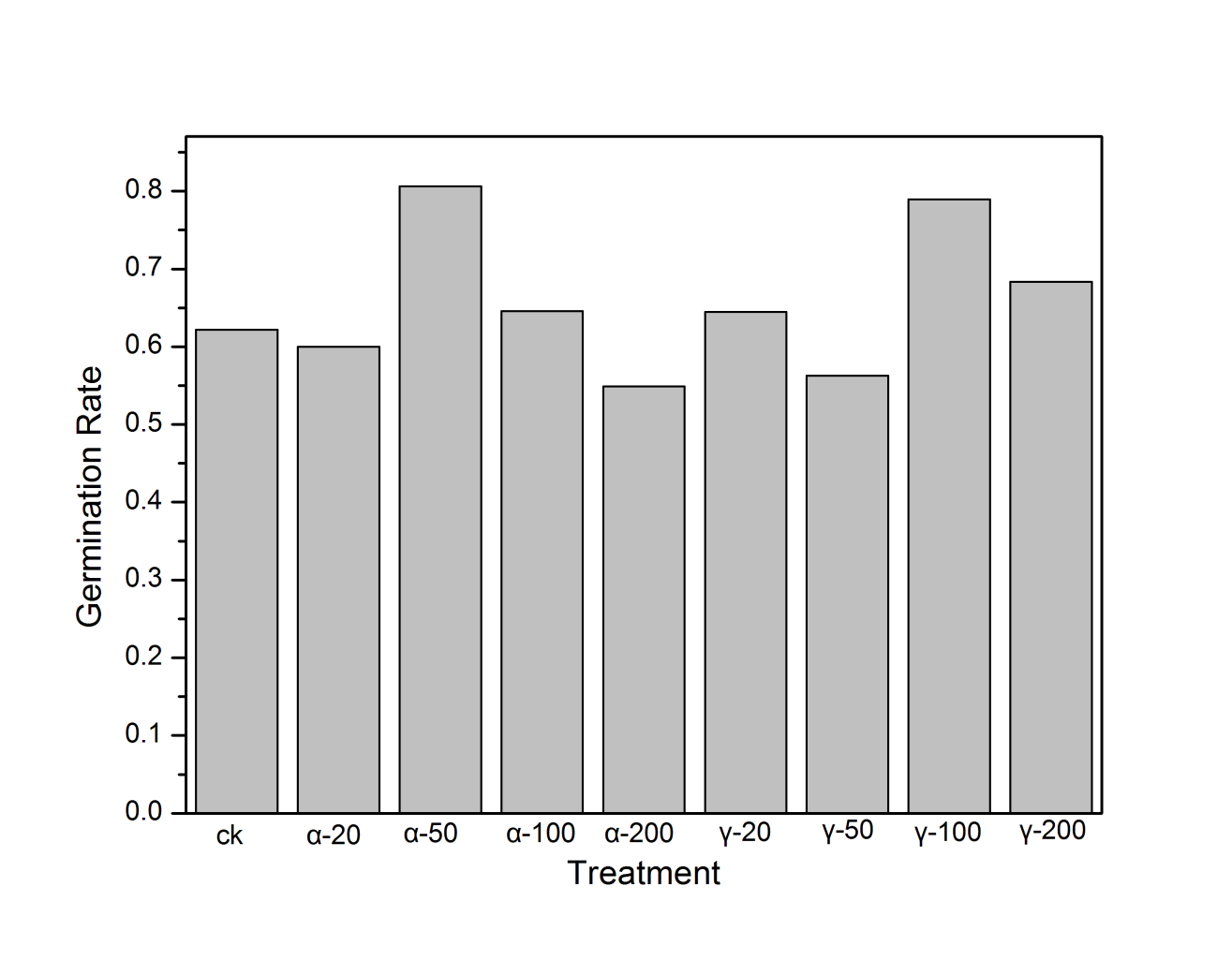
挑选籽粒丰满,大小基本一致的小麦种子作为实验材料,经过5% NaClO和75%乙醇处理后,用15 ml处理溶液(蒸馏水,20、50、100、200 ppm的α-Fe2O3或20、50、100、200 ppm的γ-Fe2O3)对小麦种子进行浸泡处理,四小时后取出种子,放在铺了滤纸的培养皿里,然后盖了一张滤纸,每个处理两个皿用于生理指标检测。除此之外还有一个皿里面放了8颗,用于测量根长。每皿加3 ml对应溶液,30摄氏度避光培养。
十九小时后,每隔两小时记录种子根长,共五次。其余种子萌发三天后测量种子的丙二醛(MDA)含量、可溶性蛋白的含量、超氧化物歧化酶(SOD)的活性、过氧化物酶(POD)的活性、过氧化氢酶(CAT)的活性等生理指标。
无处理种子经5% NaClO和75%乙醇处理后,于垫有纱布的催芽盘上在人工气候箱中28摄氏度恒温催芽,露白后播于干净海绵中培养。
2.2水培处理
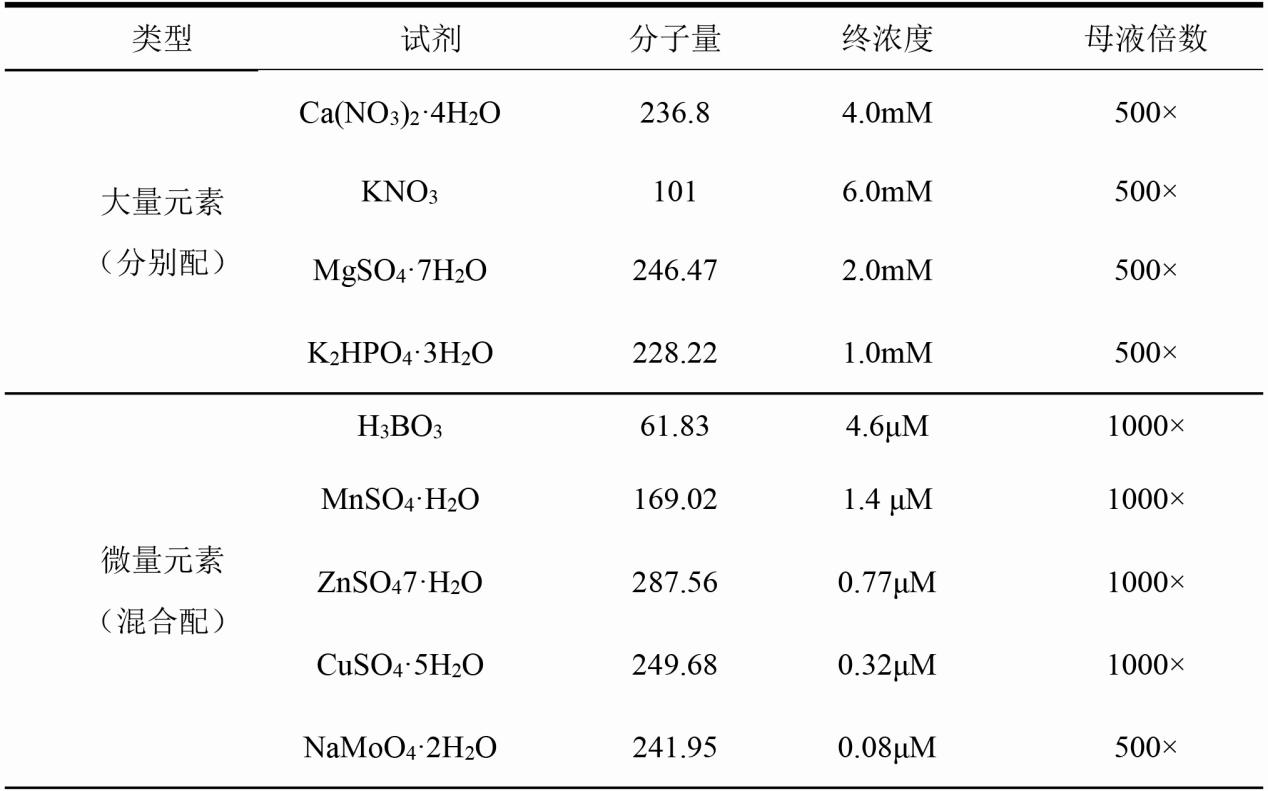
2.2.1小麦营养液配方
表2.3小麦缺铁营养液[33]配方
2.2.2处理液的配置
步骤一:纳米溶液配制
称取纳米粒子α-Fe2O3、γ-Fe2O3、Fe3O4各0.2 g,分别溶于500 ml去离子水中,连续超声3天,每天超声近10 h,直至将其超声溶解成为均匀的悬浮液。
步骤二:离子溶液的配制
①Fe2 溶液:称取0.4352 g FeSO4·7H2O,溶于100 ml水中。
②Fe3 溶液:称取0.4231 g FeCl3·6H2O,溶于100 ml水中。
③EDTA-Fe溶液:称取0.139 g的 FeSO4·7H2O和0.186 g的 EDTA-Na2混合溶于100 ml的水中。
每种溶液都需要超声30 min从而保证使其充分地溶解。
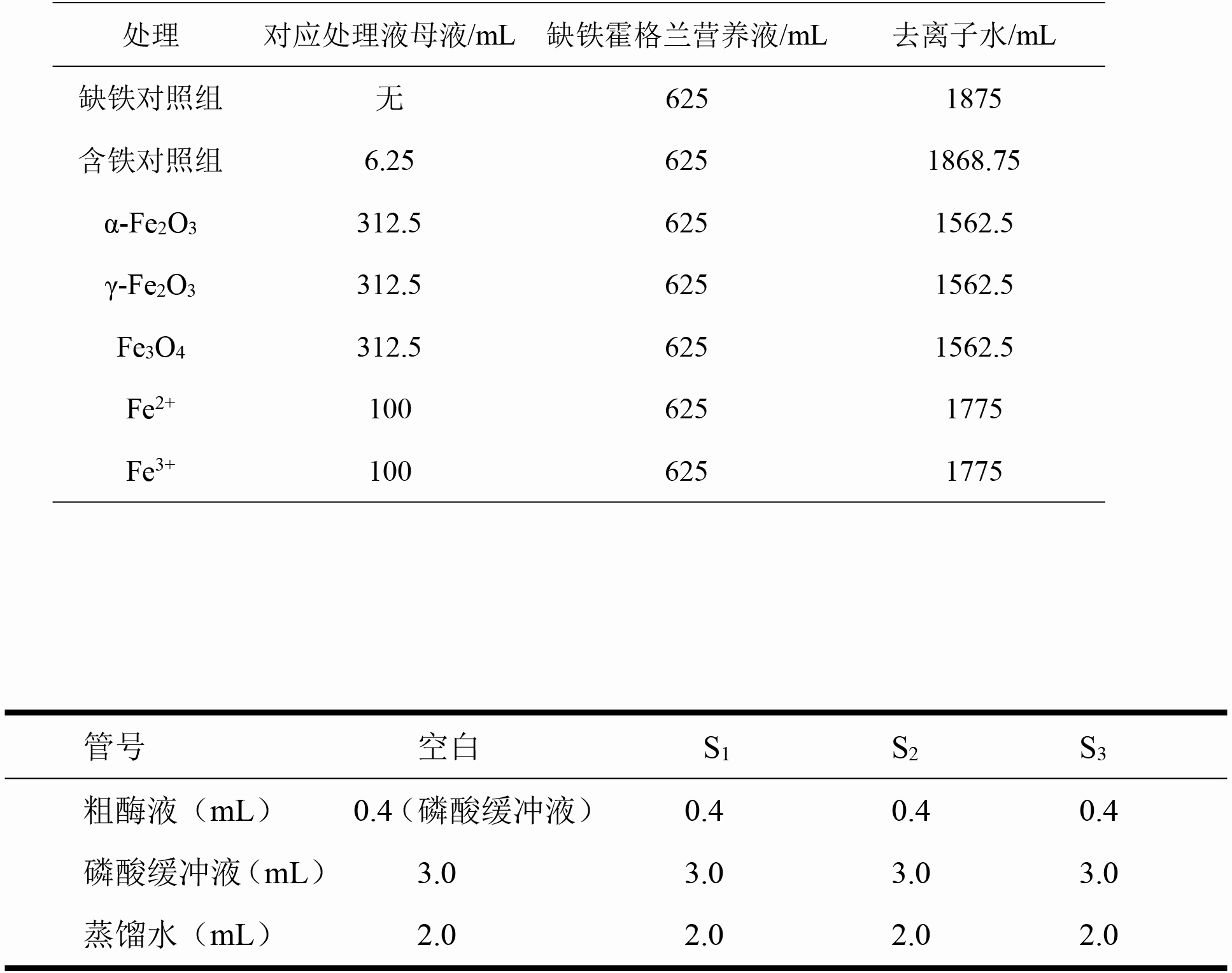
表2.4处理时溶液量
2.2.3根灌处理方法
①缺铁营养液
②50 μM Fe(II)-EDTA
③50 ppm α-Fe2O3
④50 ppm γ-Fe2O3
⑤50 ppm Fe3O4
⑥Fe2 (与氧化铁中的铁含量相同)
⑦Fe3 (与氧化铁中的铁含量相同)
1. 培育小麦幼苗[34],选取大小相近、长势良好的幼苗,用海绵固定到培养盆中,每盆18颗幼苗,共16盆,加入去离子水在人工气候箱中培养一段时间。
2. 培养48 h后,改用1/4缺铁营养液水培。培养48h后选择其中7盆分别用1/4缺铁营养液以及50 μM Fe(II)-EDTA、50 ppm α-Fe2O3 、50 ppm γ-Fe2O3 、50 ppm Fe3O4、Fe2 (与氧化铁中的铁含量相同)、Fe3 (与氧化铁中的铁含量相同)水培处理;
3. 三天后,测量水培处理的叶片叶绿素的含量、丙二醛(MDA)的含量、可溶性蛋白的含量、可溶性糖的含量,超氧化物歧化酶(SOD)的活性、过氧化物酶(POD)的活性以及过氧化氢酶(CAT)的活性等生理指标。
2.3 小麦叶片各生理指标的测法
2.3.1叶绿素含量的测定
选取小麦幼苗叶片若干,将叶片组织表面上的污物擦净然后将其剪碎。及时称取剪碎的小麦叶片样品2 g。将样品放入加了少量石英砂和碳酸钙粉以及3 mL 95%乙醇的研钵中,将其研磨成匀浆。用乙醇将匀浆定容至10ml,然后继续研磨到组织变白。静置过夜。
取上述叶绿体[35]的色素提取液在波长645 nm和665 nm下测量各组吸光度,其中以95%乙醇做为空白对照。
分别计算植物样品中的叶绿素a含量、叶绿素b含量以及总的叶绿素的含量,各色素含量计算方式如下:
叶绿素a= (12.7 A665 -2.69 A645)×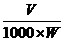 (2.1)
(2.1)
叶绿素b=(12.7 A645 - 2.69A665)×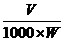 (2.2)
(2.2)
总叶绿素=(20.0A645 8.02 A665)×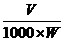 (2.3)
(2.3)
2.3.2可溶性蛋白含量的测定
采用G-250考马斯亮蓝染色法[36]测定实验样品中可溶性蛋白的含量。各组称取0.3 g新鲜的小麦根和叶片,加磷酸缓冲液(pH=7.8)充分研磨成浆,混合液在 4000 rpm 离心 10 分钟,得到蛋白质上清液。取0.1 mL可溶性蛋白提取液向其中依次加入0.9 mL蒸馏水,考马斯亮蓝G-250(0.1%)溶液5 mL,混匀后静置2 min,然后用分光光度计在595 nm波长下测定各组样品的吸光度值,并记录各组别的读数。
以上是毕业论文大纲或资料介绍,该课题完整毕业论文、开题报告、任务书、程序设计、图纸设计等资料请添加微信获取,微信号:bysjorg。
相关图片展示:
课题毕业论文、开题报告、任务书、外文翻译、程序设计、图纸设计等资料可联系客服协助查找。



