毕赤酵母老黄酶OYE2.8的酶学性质研究毕业论文
2020-05-15 22:28:15
摘 要
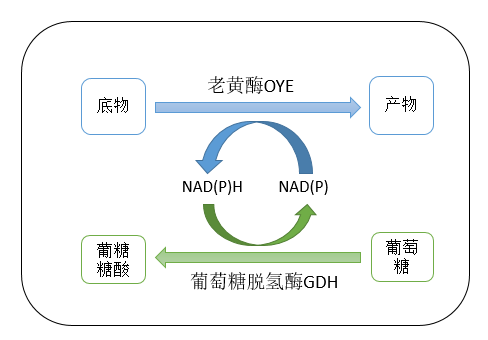
C=C双键的不对称还原因为其可以产生含有多至两个手性中心的化合物,并且这些化合物通常都是有机合成中的重要手性砌块,已经成为使用最广泛的生产手性化合物的合成方法之一。老黄酶 ([EC 1.6.99.1])是一类典型的可以还原C=C双键的酶。研究表明老黄酶的底物谱十分广泛,包括 α,β-不饱和醛酮,硝基烯,羧酸及各种衍生物。本研究将对来源于毕赤酵母的老黄酶OYE2.8的性质进行系统地研究。老黄酶是一种依赖于辅酶 NAD(P)H 发挥催化作用的氧化还原酶,本实验所用辅酶 NAD(P)H 价格昂贵,考虑应用更经济的辅酶再生体系等替代 NAD(P)H 的利用,达到节约生产成本的目的。
在对毕赤酵母的老黄酶OYE2.8的性质进行系统研究中发现:在磷酸钾缓冲体系中酶活力最高,因此后续实验均使用磷酸钾缓冲;
在温度研究中发现,OYE2.8在25℃-45℃范围内具有较高活性,其最适温度在35℃左右;在pH研究中发现,pH在5-10之间酶具有较高活性,其最适pH在在6.5-7.5之间;
在底物谱的研究中发现,OYE2.8对Maleimide、2-cyclopenten-1-one、3-Phenyl-2-methylpropena活性较高,分别为1.79 Umg-1、1.43 Umg-1、1.5 Umg-1;
在动力学参数的研究中发现,OYE2.8对NADPH亲和力和催化效率较高。
在金属离子的研究中发现,Cu2 、Zn2 和Ca2 对老黄酶OYE2.8都有抑制作用,其中5mM的Cu2 使老黄酶OYE2.8完全丧失了活性;
在有机溶剂耐受性研究中发现,随着有机溶剂浓度的不断增加,OYE2.8的酶活也在相应地不断降低。其中,OYE2.8在乙醇、异丙醇、乙酸乙酯、甲醇中酶活性较低,而在乙酸丁酯和邻苯二甲酸二丁酯中酶的活性较高,可以维持 。
关键词:老黄酶 碳碳双键还原 性质研究 基因突变
Studies on gene cloning, expression and enzymatic characterization of OYE2.8 from Pichia
Abstract
The asymmetric reduction of C=C bonds is one of the most important reactions because it can generate up to two chiral centers. And the Old Yellow Enzyme (OYE) [EC 1.6.99.1] family is well known to catalyze C=C bonds. The substrates spectrum of OYEs are very broad, including actived ketones, aldehydes, imides, carboxylic acids, terpenoids, nitroalkenes and their derivatives.
In this paper, we obtained OYE2.8 from Pichia.
In the research of buffer system, different buffer system, to OYE2.8 enzyme activity have great influence. Among them, the impact on the enzyme activity of minimum of potassium phosphate buffer system, and sodium acetate buffer system had the greatest influence on enzyme activity
In the study of substrate spectrum, it was found that OYE2.8 has activities towards imides, α,β- unsaturated aldehydes and ketones and terpenoids, but no activities detected toward nitroalkenes, carboxylic acids and anhydrides.
In the study of kinetic parameters, it was found that the Km and kcat toward NADPH of OYE2.8 is high values.
In the study of the tolerance to metal ions, it was found that Cu2 was obviously inhibitors towards the enzyme,it losts all the activities at the condition of 5mM Cu2 .
When study the catalysis properties, the ee values of OYE2.8 is not good .
In organic solvent tolerance study,we found that with increasing the concentration of organic solvent, OYE2.8 enzyme activity are decrease accordingly. Including ethanol, isopropyl alcohol, ethyl acetate and methanol have bigger influence on the enzyme, and butyl acetate and butyl phthalate have less effect on the enzyme.
Overall, we have researched the enzyme properties in the round, which will be useful for the further research of OYEs.
KEYWORDS:Old Yellow Enzyme: Asymmertric reduction of C=C bonds;Enzyme properties; Mutations
目 录
摘 要 I
ABSTRACT II
第一章 文献综述 1
1.1老黄酶简介 1
1.2老黄酶的催化机理 2
1.3老黄酶催化的不对称还原反应 3
2.1本研究的目的和意义 6
3.1本论文的主要研究内容 6
第二章 实验材料与方法 7
2.1实验材料 7
2.1.1 实验仪器 7
2.1.2 实验试剂 8
2.1.3 工具酶及试剂盒 10
2.1.4 菌株与质粒 11
2.1.5 培养基和培养方法 11
2.2实验方法 12
2.2.1 老黄酶基因的获取 12
2.2.2重组质粒的构建 13
2.2.3老黄酶基因的纯化 15
2.2.4蛋白SDS-PAGE检测 15
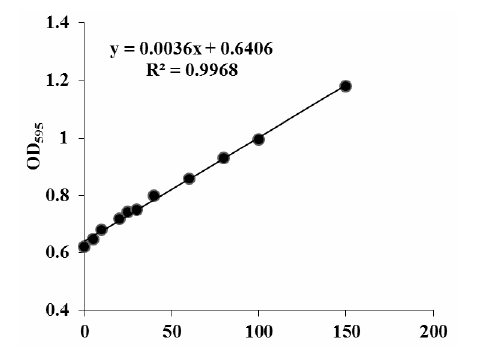
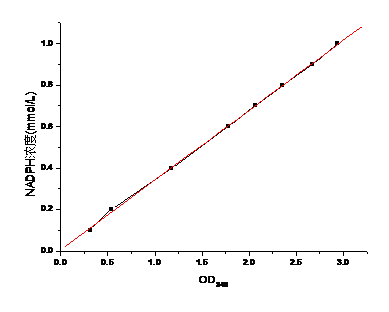
2.2.5老黄酶基因的酶活检测 17
2.2.6老黄酶基因的表达 18
2.3老黄酶的酶学性质研究 18
2.3.1缓冲体系对老黄酶OYE2.8的影响 18
2.3.2最适温度和温度稳定性的研究 18
2.3.3最适pH和pH稳定性的研究 18
2.3.4底物谱研究 19
2.3.5动力学参数的研究 21
2.3.6不同的金属离子对老黄酶的影响 22
2.3.7 有机溶剂耐受性研究 22
2.3.8催化性质研究 22
第三章 实验结果与讨论 25
3.1 OYE2.8基因的克隆与表达 25
3.1.1OYE2.8基因的克隆 25
3.1.2 OYE2.8基因的表达 27
3.1.3老黄酶OYE2.8的纯化 28
3.2 老黄酶OYE2.8的酶学性质研究 28
3.2.1 缓冲体系对老黄酶OYE2.8的影响 28
3.2.2 老黄酶的最适温度和温度稳定性研究 29
3.2.3 老黄酶OYE2.8的最适pH和pH稳定性研究 30
3.2.4 老黄酶OYE2.8的底物谱研究 32
3.2.5 老黄酶OYE2.8的动力学参数研究 34
3.2.6不同的金属离子对老黄酶的影响 35
3.2.7有机溶剂耐受性研究 36
3.2.8老黄酶OYE2.8的催化性质研究 37
第四章 结论与展望 39
4.1 结论 39
4.2 展望 40
参考文献 41
致谢 43
第一章 文献综述
1.1老黄酶简介
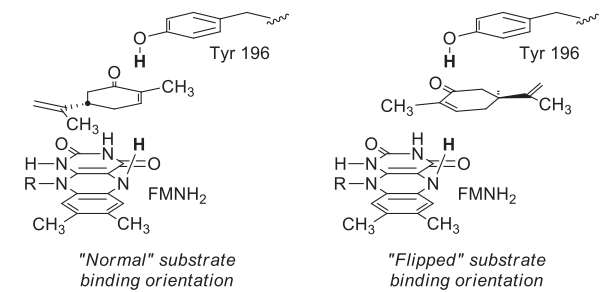
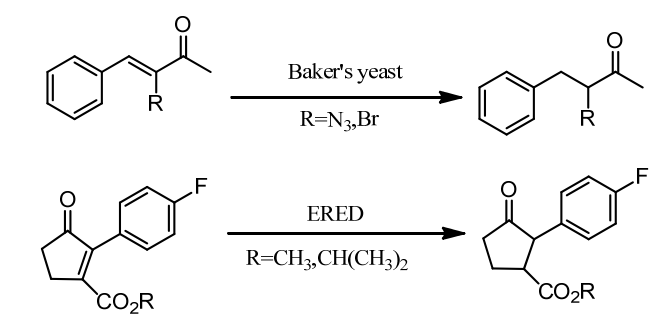
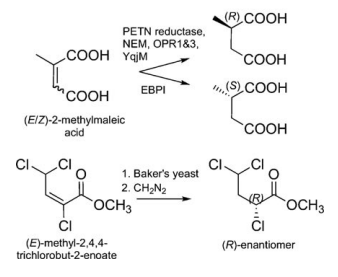
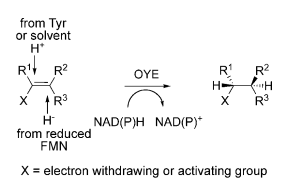 在精细化学品,药物,农药中间体的研究领域,生物催化法因为其高效率、高立体选择性和低成本已经日益成为一种完善常用的合成途径[1]。而C=C双键的不对称还原因为其可以产生含有多至两个手性中心的化合物,并且这些化合物通常都是有机合成中的重要手性砌块,已经成为使用最广泛的生产手性化合物的合成方法之一[2, 3]。近年来,生物催化的方法被越来越多地应用到C=C双键的还原中,并且已经逐渐形成高效完善的合成途径[4, 5]。相较于其它方法而言,生物催化法更加安全,立体选择性更高,成本更低,但是适合用于生物催化的酶还在持续寻找中。
在精细化学品,药物,农药中间体的研究领域,生物催化法因为其高效率、高立体选择性和低成本已经日益成为一种完善常用的合成途径[1]。而C=C双键的不对称还原因为其可以产生含有多至两个手性中心的化合物,并且这些化合物通常都是有机合成中的重要手性砌块,已经成为使用最广泛的生产手性化合物的合成方法之一[2, 3]。近年来,生物催化的方法被越来越多地应用到C=C双键的还原中,并且已经逐渐形成高效完善的合成途径[4, 5]。相较于其它方法而言,生物催化法更加安全,立体选择性更高,成本更低,但是适合用于生物催化的酶还在持续寻找中。
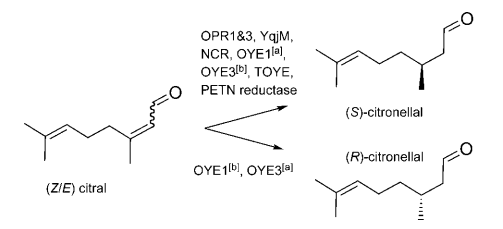
图1-1. 老黄酶催化的不对称还原的底物[4]
相关图片展示:
课题毕业论文、开题报告、任务书、外文翻译、程序设计、图纸设计等资料可联系客服协助查找。



